题目内容
【题目】今年3月22日是第二十二届“世界水日”,3月22﹣28日是第二十七届“中国水周”.联合国确定“世界水日”的宣传主题是“水与能源”(Water and Energy).水与人类的生活和生产密切相关.如图为我国《生活饮用水国家标准》的部分内容,请回答下列问题.

(1)测得某地区合格饮用水的pH=6.6,可知略呈_____性(填“酸”或“碱”),通常是因为水中有一种常见弱酸是_____(填化学式).
(2)生活饮用水中的铝元素以铝离子形式存在,则3个铝离子表示为_____,铁元素以硫酸铁形式存在,硫酸铁的化学式为_____.
(3)天然水中含有许多杂质,可利用吸附、沉淀、过滤和蒸馏等方法净化,其中净化程度最高的方法是_____.
(4)(选做)天然水的硬度较大时,煮沸后饮用是降低硬度的方法之一,其化学原理是Ca(HCO3)2、Mg(HCO3)2加热后发生反应生成了水垢.Ca(HCO3)2加热分解为碳酸钙、二氧化碳和水,请写出化学方程式_____,Mg(HCO3)2加热后分解为氢氧化镁和二氧化碳,请写出化学方程式_____,因而水垢的主要成分有2种,请写出醋酸(用HAc代表醋酸)与水垢中碳酸钙反应的化学方程式_____.
(5)1升合格的生活饮用水中,均以CaCO3计算硬度,则钙元素的含量应不超过_____mg.
【答案】酸 H2CO3 3Al3+ Fe2(SO4)3 蒸馏 Ca(HCO3)2![]() CaCO3↓+CO2↑+H2O Mg(HCO3)2
CaCO3↓+CO2↑+H2O Mg(HCO3)2![]() MgCO3↓+CO2↑+H2O CaCO3+2 HAc=Ca(Ac)2+CO2↑+H2O 180.
MgCO3↓+CO2↑+H2O CaCO3+2 HAc=Ca(Ac)2+CO2↑+H2O 180.
【解析】
(1)某地区合格饮用水的pH=6.6,小于7,显酸性;显酸性是因为二氧化碳与水反应生成一种常见弱酸碳酸的缘故.
(2)根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字;因此3个铝离子表示为:3Al3+.硫酸铁中铁元素显+3价,硫酸根显﹣2价,故其化学式为 Fe2(SO4)3.
(3)蒸馏的方法可以得到纯水,所该方法是净化程度最高的.
(4)Ca(HCO3)2加热分解为碳酸钙、二氧化碳和水,反应的化学方程式为:Ca(HCO3)2![]() CaCO3↓+CO2↑+H2O;
CaCO3↓+CO2↑+H2O;
Mg(HCO3)加热后分解为氢氧化镁和二氧化碳,反应的化学方程式为:Mg(HCO3)2![]() MgCO3↓+CO2↑+H2O;
MgCO3↓+CO2↑+H2O;
醋酸(用HAc代表醋酸)与水垢中碳酸钙反应生成醋酸钙、水和二氧化碳,反应的化学方程式为:CaCO3+2 HAc=Ca(Ac)2+CO2↑+H2O.
(5)根据题意,生活饮用水的总硬度(以CaCO3计)极限值为450mg/L,则钙元素的含量应不超过450mg×![]() ×100%=180mg.
×100%=180mg.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】小明同学把黑色的氧化铜粉末与黑色的木炭粉均匀混合后,放入试管内加热到高温,充分反应后,试管内除有红色物质产生外,仍有黑色固体残留.
[提出问题]这黑色残余固体是什么物质?
[猜想与假设]
(1)残余固体是碳;
(2)残余固体是_____;
(3)残余固体是碳与氧化铜的混合物.
[分析与实验]:
(1)以上实验发生反应的化学方程式为_____
(2)小亮同学认为猜想(3)可以排除,他的理由是_____
(3)小明设计如下简单的实验进行,请你代小明填写下表
实验过程 | 实验现象 | 结论 |
取少量黑色固体加入 足量的稀硫酸 | ①_____ | 猜想(1)正确 |
②_____ | 猜想(2)正确 |
(4)小明想把铜粉中的木炭除去获得纯净的铜粉;于是他把该混合物放置在空气中灼烧.请问他的实验能否成功,为什么?_____.
【题目】人类的生存离不开氧气,某校化学兴趣小组的同学在老师的指导下做了有关氧气的系列探究实验。
(探究一)某同学称取一定质量的高锰酸钾(KMnO4)放在大试管中,将温度控制在250℃加热制取氧气(O2),实验结束时,该同学发现收集到的氧气(O2)大于理论产量,针对这一现象,同学们进行了如下探究:
(提出猜想)猜想Ⅰ:反应生成的二氧化锰(MnO2)分解放出氧气(O2)
猜想Ⅱ:反应生成的锰酸钾(K2MnO4)分解放出氧气(O2)
(实验验证)同学们分为两组,分别进行以下实验:
(1)第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变。则猜想_____错误。
(2)第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论。 该组同学选择的实验方法是_____。
(探究二)以下是某小组探究影响过氧化氢(H2O2)溶液反应速率部分因素的相关实验数据。
实验序号 | H2O2溶液 浓度% | H2O2溶液体积/mL | 温度/℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
(1)通过实验①和②对比可知,化学反应速率与_____有关;
从实验③和④对比可知,化学反应速率与温度的关系是:_____。
(2)如果要证明MnO2是该反应的催化剂,还要补做2个实验:
①_____;②_____。(不要写出具体步骤)
(探究三)某化学兴趣小组的同学对空气中氧气含量的测定实验进行探究。
已知:在空气中,温度超过40℃,白磷(化学符号为P)就可以自燃,即和氧气反应生成五氧化二磷。
如图是“空气中氧气体积分数测定”实验的改进装置。主要操作:在实际容积为250mL的集气瓶里,先装进50mL的水,再按图连好仪器,按下热的玻璃棒,白磷立即被点燃。
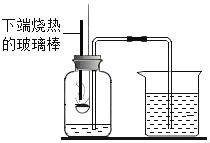
(1)请写出白磷与氧气反应的文字或符号表达式为_____,该反应的类型是_____(填“化合反应”或“分解反应”)。
(2)白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是_____;若实验非常成功,最终集气瓶中水的体积约为_____mL。
(3)集气瓶里预先装进的50mL水,在实验过程中起到哪些作用?_____(填写序号,可以多选)
a加快集气瓶冷却
b液封导气管末端,防止气体受热逸出
c缓冲集气瓶内气压的骤然升高