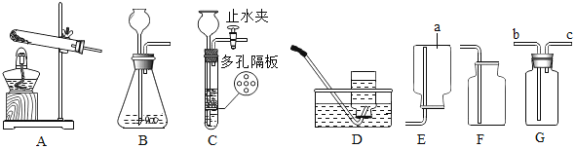
题目内容
【题目】某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液。
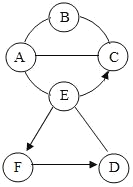
(已知氯化钙溶液呈中性)。在溶液中插入pH传感器,测得pH变化曲线如下图所示,下列有关说法不正确的是
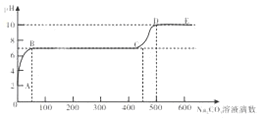
A. 开始时溶液pH=2是因为残留液中还有盐酸剩余
B. AB段表示随着Na2CO3溶液的滴入,CaCO3沉淀的质量逐渐增加
C. C点表示此时溶液呈中性
D. D点溶液中含有的溶质是NaCl和Na2CO3
【答案】B
【解析】
碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,和氯化钙反应生成碳酸钙沉淀和氯化钠。碳酸钠加入到氯化钙和盐酸的混合溶液中,碳酸钠先消耗盐酸,当盐酸完全消耗后,再消耗氯化钙产生碳酸钙的沉淀。
A、开始时溶液pH=2是因为残留液中还有盐酸剩余,故A正确,不符合题意;
B、AB段表示随着Na2CO3溶液的滴入,稀盐酸不断反应,溶液酸性减弱,pH升高,没有碳酸钙生成,故B不正确,符合题意;
C、C点表示碳酸钠恰好和氯化钙完全反应,此时溶液中含有氯化钠,溶液呈中性,故C正确,不符合题意;
D、D点溶液中碳酸钠过量,含有的溶质是NaCl和Na2CO3,故D正确,不符合题意。故选B。

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】小明同学把黑色的氧化铜粉末与黑色的木炭粉均匀混合后,放入试管内加热到高温,充分反应后,试管内除有红色物质产生外,仍有黑色固体残留.
[提出问题]这黑色残余固体是什么物质?
[猜想与假设]
(1)残余固体是碳;
(2)残余固体是_____;
(3)残余固体是碳与氧化铜的混合物.
[分析与实验]:
(1)以上实验发生反应的化学方程式为_____
(2)小亮同学认为猜想(3)可以排除,他的理由是_____
(3)小明设计如下简单的实验进行,请你代小明填写下表
实验过程 | 实验现象 | 结论 |
取少量黑色固体加入 足量的稀硫酸 | ①_____ | 猜想(1)正确 |
②_____ | 猜想(2)正确 |
(4)小明想把铜粉中的木炭除去获得纯净的铜粉;于是他把该混合物放置在空气中灼烧.请问他的实验能否成功,为什么?_____.