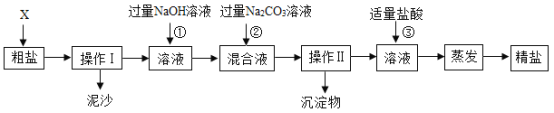
题目内容
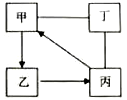
【题目】已知:①金属钠是一种活泼的金属,与水反应生成氧氧化钠和氢气;②难溶于水的碱受热分解生成相应的氧化物和水。A、B、C、D、E、F、G、H是初中化学中常见的物质,甲、乙、丙是三种金属。其中甲最活泼,乙是红色金属,丙能被磁铁吸引。各物质间相互转化关系如下图:
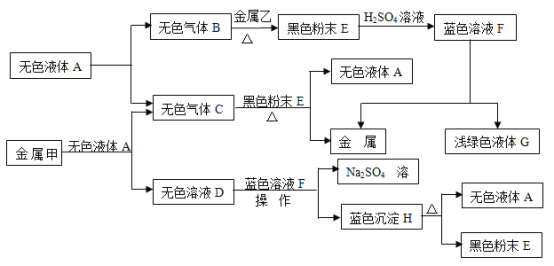
请回答下列问题:
(1)写出A、E、G的化学式:A_____,E_____,G_____。
(2)操作X的名称是______。
(3)①无色溶液D与蓝色溶液F反应的化学方程式为___________;
②金属甲与无色液体A反应的化学方程式为________________________,该反应的基本类型______;
③蓝色沉淀H受热分解反应的化学方程式为______________。
(4)甲、乙、丙三种金属的活动性由强到弱的顺序是_______,无色气体C在点燃或加热前必须进行的操作是______。
【答案】H2O CuO FeSO4 过滤 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ 2Na+2H2O=2NaOH+H2↑ 置换反应 ![]() 甲丙乙 检验气体的纯度或验纯
甲丙乙 检验气体的纯度或验纯
【解析】
乙是红色金属,丙能被磁铁吸引,说明乙是金属铜,丙是金属铁;金属甲和无色液体A反应生成无色气体C和无色溶液D,而且溶液D还能够和蓝色溶液F即硫酸铜溶液反应,因此无色溶液D为碱溶液即氢氧化钠溶液,则金属甲为钠,无色液体A为水,无色气体C为氢气,则蓝色沉淀就为氢氧化铜,由于难溶于水的碱受热分解生成相应的氧化物和水,则黑色粉末为氧化铜;由于水在通电条件可以生成氧气和氢气,则无色气体B就是氧气.
(1)根据一种无色液体可以分解得到两种气体,可推出A是水,进而可以顺推出E是氧化铜,而G是浅绿色溶液,且是由硫酸铜反应所得,因此G应为硫酸亚铁溶液,故答案为:H2O,CuO,FeSO4
(2)由于操作X把沉淀和溶液分开,因此该操作是过滤,故答案为:过滤
(3)①由于D是氢氧化钠溶液,蓝色溶液F是硫酸铜溶液,故答案为:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
②由于甲是金属钠,无色液体A是水,而且两者发生的反应是一种单质和一种化合物反应生成了另外一种单质和一种化合物,故答案为:2Na+2H2O=2NaOH+H2↑,置换反应
③由于难溶性碱加热分解生成金属氧化物和水,故答案为:![]() 。
。
(4)在金属活动性顺序中,越靠前的金属化学性质越活泼,因此甲(钠)、乙(铜)、丙(铁)的活动性由强到弱的顺序是甲>丙>乙;由于氢气具有可燃性,因此在点燃或加热前必须要验纯。故答案为:甲、丙、乙,检验气体的纯度或验纯。

 名校课堂系列答案
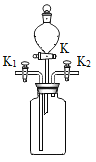
名校课堂系列答案【题目】某研究小组对自动充气气球(示意图如下)进行下列探究。
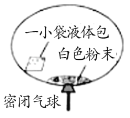
(查阅资料)该反应充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
(1)通常用澄清的石灰水来检验气体是二氧化碳,该反应的化学方程式 为_____。
(2)室温时,用pH试纸测得溶液的pH=3,该溶液呈_____性。
(3)探究白色粉末成分:
(猜想与假设)甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠。
(设计并进行实验)
实验一:完成下表:
操作步骤 | 现象 | 结论 |
_____ | _____ | 甲同学的猜想不正确 |
实验二:室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的稀盐酸,并测量生成二氧化碳的体积(装置如图),记录如下表:
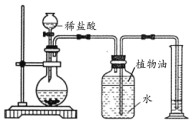
实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
名称 | 质量/g | ||
① | 碳酸氢钠 | 0.8 | V1 |
② | 碳酸钠 | 0.8 | V2 |
③ | 白色粉末 | a | V1 |
(4)实验装置中植物油的作用是_____;表中a=_____;V1_____V2(填“﹥”、“﹤”或“=”)。
(分析并得出结论)
(5)分析上表中数据得出结论:白色粉末的成分是_____,依据是_____。