题目内容
【题目】小明在社会实践中喜欢收集各种颜色的矿石。他收集到下列矿石样品。

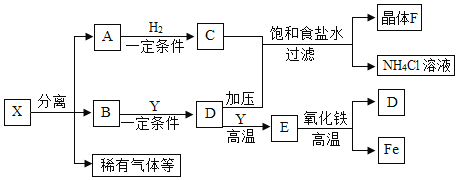
(1)上述矿石的主要成分为氧化物的是_____。
(2)赤铁矿可用来炼铁,工业上用赤铁矿炼铁的化学方程式为____。用含氧化铁50%的赤铁矿500吨炼铁,理论上炼出铁的质量为______(写计算式)。
【答案】A 
![]()
【解析】
(1)赤铁矿的主要成分是![]() ,是由两种元素组成的且有一种是氧元素的化合物,属于氧化物;孔雀石中主要成分是
,是由两种元素组成的且有一种是氧元素的化合物,属于氧化物;孔雀石中主要成分是![]() 是由四种元素组成的化合物,不属于氧化物;闪锌矿的主要成分是
是由四种元素组成的化合物,不属于氧化物;闪锌矿的主要成分是![]() ,是不含氧元素的化合物,不属于氧化物;黄铁矿的主要成分是
,是不含氧元素的化合物,不属于氧化物;黄铁矿的主要成分是![]() ,不含有氧元素,不属于氧化物;故填:A;
,不含有氧元素,不属于氧化物;故填:A;
(2)工业上用一氧化碳还原氧化铁炼铁,主要是利用![]() 的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为:
的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为: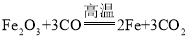 。
。
设理论上可炼出铁的质量为x,则
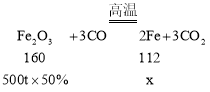
![]() 。
。

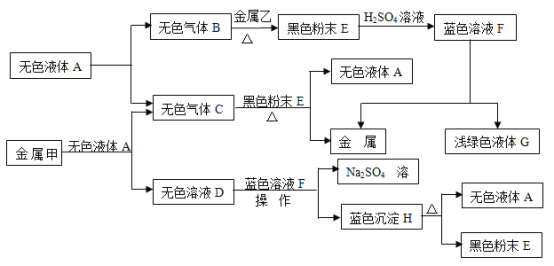
【题目】有实验室有一包白色粉末,可能含有![]() 和
和![]() 中的一种或几种,为了确定其成分,某化学兴趣小组进行了如下探究。
中的一种或几种,为了确定其成分,某化学兴趣小组进行了如下探究。
(查阅资料)![]() 固体不溶于水,也不溶于稀盐酸。
固体不溶于水,也不溶于稀盐酸。
(实验探究)
(1)甲同学设计了如下的实验方案。
实验步骤 | 实验现象 | 实验结论 |
a取少量该粉末于试管中,加入足量水充分溶解 | 有白色沉淀 | 有原粉末中一定含有 |
b将步骤a试管中物质过滤,向滤液中滴加酚酞溶液 | 溶液变红 | 原粉末一定含有_______ |
(2)乙同学认为甲同学步骤a的结论不一定正确,其理由是_______,他补充了如下实验,取白色沉淀于试管中,加入足量稀盐酸,观察到有气泡产生且_______,从而得出结论:步骤a中得到的白色沉淀全部是![]() ;
;
(3)丙同学取甲同学步骤b中已变红的溶液,向其中逐滴滴入稀硫酸,发现有白色沉淀生成且溶液褪色.根据有白色沉淀生成的现象确定原粉末中一定有________,一定没有________;溶液褪色的原因用化学方程式表示为_______。
(总结归纳)通过以上探究,原白色粉末中无法确定的成分是_______(填化学式)
【题目】下列实验操作,能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 验证NaCl溶液中混有盐酸 | 取少量溶液,滴加无色酚酞溶液 |
B | 除去NaOH中混有的碳酸钠 | 滴加足量盐酸、蒸发 |
C | 比较Zn、Cu、Ag的金属活动性 | 将Zn和Ag分别放入CuSO4溶液中 |
D | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、蒸发 |
A.AB.BC.CD.D
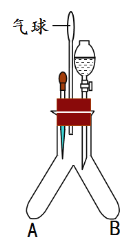
【题目】利用下图装置进行实验。
内容 装置 | I探究燃烧的条件(已知白磷的着火点为40℃) | II验证使石蕊变色的是碳酸而不是二氧化碳 |
| ①将胶头滴管内吸入约2mL冷水,在分液漏斗内放入约20mL开水。 ②在A管中装入一小块白磷。并塞进橡胶塞。 ③将冷水和开水分别放入A、B支管内。 ④倾斜Y型管,将B中开水倒入A中。 ⑤再次倾斜Y型管,将A中热水(约90℃)倒入B中。 | ①在Y型管的A管中装入用石蕊浸泡的干燥的紫色小花 ②在Y型管的B管中加入适量碳酸钠。 ③将胶头滴管内吸入蒸馏水,塞进橡胶塞。向分液漏斗内注入稀硫酸。 ④…… |
(1)实验I 中发生反应的化学方程式为_____。
(2)实验I中能证明燃烧可燃物温度需要达到着火点的现象是_____。
(3)实验II中B管内将发生反应的化学方程式为_______。
(4)实验II中步骤④的具体操作是______。