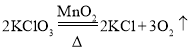题目内容
【题目】根据以下课本实验图,回答下列问题:
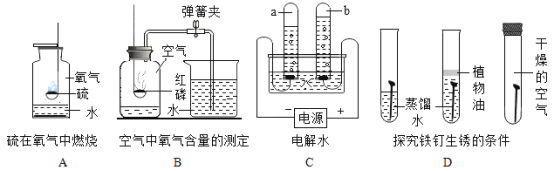
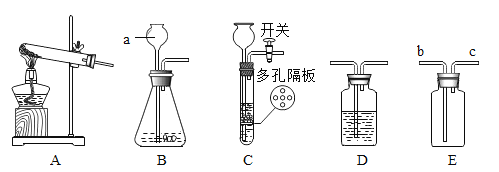
(1)A实验集气瓶中水的作用是_____;
(2)B实验燃烧匙慢慢伸入集气瓶会导致实验结果_____(选填“偏大”或“偏小”);
(3)C实验中a、b两试管中气体的质量比_____;
(4)从D实验中可以得到的结论是_____。
【答案】吸收SO2,防止污染空气 偏大 1:8 铁生锈需要铁与氧气和水共同作用
【解析】
(1)硫燃烧生成二氧化硫,是空气污染物,但二氧化硫能与水反应,A实验集气瓶中水的作用是吸收SO2,防止污染空气;
(2)测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使瓶内气体减少,压强变小,水倒流入集气瓶内,倒流的水的体积就等于瓶内氧气的体积。磷燃烧放出大量的热,B实验燃烧匙如慢慢伸入集气瓶,会导致瓶内气体受热膨胀逸出,实验结果偏大;
(3)电解水时,正极产生氧气,负极产生氢气,反应方程式为:2H2O ![]() 2H2↑+ O2↑,C实验中a、b两试管中气体的质量比(即氢气、氧气的质量比)(2×2):(1×32)=1:8;
2H2↑+ O2↑,C实验中a、b两试管中气体的质量比(即氢气、氧气的质量比)(2×2):(1×32)=1:8;
(4)从D实验中,没有水或没有氧气时均不生锈,铁与氧气、水共存时生锈,可以得到的结论是铁生锈需要铁与氧气和水共同作用。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目