题目内容
【题目】根据如图所示实验回答问题。
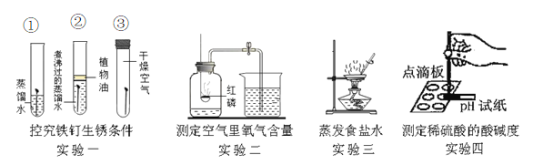
(1)实验一:会出现明显现象的试管是___________(填序号),说明铁生锈实际上是铁与_____________发生反应。
(2)实验二:实验结束后,测量结果小于5的原因可能是_________(写一条即可),实验中发生反应的化学方程式为_______。
(3)实验三:当蒸发皿中出现______________时,停止加热。
(4)实验四:用冲洗后未擦干的玻璃捧蘸取待测液会导致测得结果__________(填“偏大” “偏小”或“不变”)。
【答案】① 氧气、水 装置的气密性不好或红磷的量不足或没有冷却到室温就打开弹簧夹读数 4P+5O2 ![]() 2P2O5 大量晶体析出时 偏大
2P2O5 大量晶体析出时 偏大
【解析】
(1)实验一:铁生锈是铁与氧气、水共同作用的结果,会出现明显现象的试管是①,②中没有氧气,铁不生锈,③中没有水不生锈,说明铁生锈实际上是铁与氧气、水发生反应;
(2)实验二:测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使瓶内气体减少,压强变小,水倒流入集气瓶内,倒流的水的体积就等于瓶内氧气的体积。实验结束后,测量结果小于5的原因可能是装置的气密性不好、红磷的量不足、没有冷却到室温就打开弹簧夹读数,实验中发生的反应是磷和氧气点燃条件下生成五氧化二磷,化学方程式为4P+5O2 ![]() 2P2O5;
2P2O5;
(3)实验三:当蒸发皿中出现大量晶体析出时或有少量液体剩余时,停止加热;
(4)实验四:用冲洗后未擦干的玻璃捧蘸取待测液,由于溶液被稀释,会导致酸的浓度降低,酸性变弱,测得结果偏大。

【题目】小华与朋友聚餐时,对火锅燃料“固体酒精”产生了好奇,于是他与同学对其成分进行如下探究。
【提出问题】固体酒精是固态酒精吗?
【查阅资料一】酒精,学名乙醇,化学式C2H5OH,熔点为-114℃,易挥发,能与水以任意比例互溶。
【交流讨论】小华认为固体酒精不是固态的酒精,他判断的理由是_________,写出酒精完全燃烧的化学方程式________________________________。
【发现问题】小华观察发现,固体酒精完全燃烧后会残留少量白色固体。
【再提问题】燃烧后残留的白色固体是什么?
【查阅资料二】固体酒精是酒精、氢氧化钠和凝固剂按一定的质量比混合制成,该凝固剂在空气中能完全燃烧生成二氧化碳和水。
【作出猜想】猜想一:氢氧化钠;猜想二:碳酸钠;猜想三:__________。你认为猜想中含有碳酸钠的理由是:____________________。(用化学方程式表示)
【实验探究】
步骤 | 实验操作 | 实验现象 | 结论 |
(1) | 将白色固体溶于足量水中 | 白色固体全部溶解 | 固体可溶于水 |
(2) | 取(1)所得少量溶液,加入过量的BaCl2溶液 | ________ | 白色固体中肯定有Na2CO3 |
(3) | 取(2)所得少量上层清液,加入______________溶液 | 有蓝色沉淀生成 | 白色固体中肯定有________ |
【反思交流】实验中,加入过量氯化钡溶液的目的是____________________________。
如果实验中发现氯化钡溶液不够,可选用下列试剂代替也能达到实验目的是____________。
A.Ca(OH)2溶液 B.Ba(NO3)2溶液 C.稀盐酸 D.CaCl2溶液
【题目】某实验小组利用石灰石残渣(杂质不溶于水也不溶于酸)制备轻质CaCO3,同时得到K2SO4,流程如下:
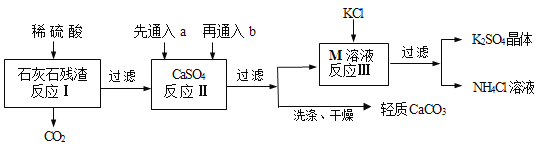
已知:CaCO3+H2O+CO2=Ca(HCO3)2
(1)为了提高反应Ⅰ的速率,下列措施中可行的是____________(填序号);
①搅拌
②将残渣粉碎成细小颗粒
③适当增大硫酸的浓度
(2)反应Ⅱ中a和b分别是_______________(填序号);
①足量CO2、适量NH3 ②足量NH3、适量CO2
③适量CO2、足量NH3 ④适量NH3、足量CO2
(3)反应Ⅲ中相关物质的溶解度如下表,该表中M物质的化学式为___________,反应Ⅲ在常温下能实现的原因是________,生成的NH4Cl溶液在农业上可用作_______________;
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)判断CaCO3固体已洗涤干净的方法:取最后一次洗涤液,______(①滴加稀盐酸、② 滴加Na2SO4 溶液、③ 滴加BaCl2溶液,填写序号),若无明显的现象,则已洗净;
(5)过滤器的制作如图,正确的顺序是______(填序号);
(6)该工艺流程中循环利用的物质除了水,还有_________________________。