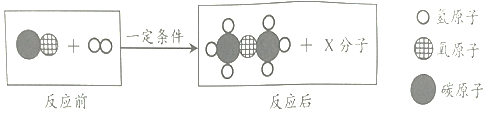
题目内容
【题目】水是生活生产中不可缺少的物质。

①日常生活和生产中常见的水,属于纯净物的是_____。
A 矿泉水 B 蒸馏水 C 河水 D 雨水
②如图甲所示的简易净化水的装置,运用了如下净水方法中的_____(填序号)。
A 消毒 B 过滤 C 蒸馏 D 吸附
③保持水的化学性质的微粒是_____(填名称),图乙中电解水的化学方程式是_____,b 试管中产生的气体是_____,检验该气体的方法是_____,实验说明水是_____由组成的。
④水中滴入几滴石蕊试液,向其中通入二氧化碳气体,可看到石蕊试液变_____色,其反应原理是_____(用化学方程式表示),该原理也可用于制碳酸饮料。打开可乐瓶有大量气泡逸出,说明压强减小,气体溶解度变_____(填“大”或“小”),当气泡逸出后,瓶内的液体_____(填“是”或“不是”)二氧化碳的饱和溶液。
⑤20℃,食盐的溶解度是 36g/100g 水,此时饱和溶液的溶质的质量分数是 26.5%.则“100g”表示_____;“%”表示_____。
A 溶质质量 B 溶剂质量 C 溶液质量 D 溶液体积
⑥将 15g 下列物质投入 85g 水中,使之充分溶解,试比较所得溶液的溶质质量分数的大小_____。
a.二氧化硫 b.氯化钠 c.硫酸铜晶体 d.氧化钙
【答案】B BD 水分子 2H2O![]() 2H2↑+O2↑ 氧气 带火星的木条伸入试管中,木条复燃则证明是氧气 氢、氧两种元素 红 CO2+H2O=H2CO3 小 是 B C a>b>c>d
2H2↑+O2↑ 氧气 带火星的木条伸入试管中,木条复燃则证明是氧气 氢、氧两种元素 红 CO2+H2O=H2CO3 小 是 B C a>b>c>d
【解析】
①A、矿泉水中含有矿物质与水,属于混合物;
B、蒸馏水中只含一种物质,属于纯净物;
C、河水中含有水和其他杂质,属于混合物;
D、雨水中含有水和其他杂质,属于混合物;
②图甲所示的简易净化水的装置,运用了过滤和吸附的净水方法;
③水是由水分子构成的,所以保持水的化学性质的微粒是水分子;水通电分解为氢气和氧气,化学方程式是:2H2O![]() 2H2↑+O2↑;b管内的气体较少,是氧气,氧气具有助燃性,可用带火星的木条来检验;电解水生成了氢气和氧气,由此可知,水是由氢元素与氧元素组成的;
2H2↑+O2↑;b管内的气体较少,是氧气,氧气具有助燃性,可用带火星的木条来检验;电解水生成了氢气和氧气,由此可知,水是由氢元素与氧元素组成的;
④二氧化碳与水反应生成碳酸,化学方程式是:CO2+H2O=H2CO3;碳酸能使紫色的石蕊试液变红色;打开可乐瓶有大量气泡逸出,说明压强减小,气体溶解度变小,当气泡逸出后,瓶内的液体仍是二氧化碳的饱和溶液;
⑤20℃,食盐的溶解度是 36g/100g 水,此时饱和溶液的溶质的质量分数是 26.5%,则“100g”表示溶剂的质量;“%”表示溶液的质量;
⑥a、15g二氧化硫溶于水生成亚硫酸,溶质的质量大于15g,溶质的质量分数大于15%;
b、15g氯化钠投入85g 水中,使之充分溶解,溶质的质量分数等于15%;
c、15g硫酸铜晶体投入85g 水中,使之充分溶解,结晶水转变成溶剂,溶质的质量分数小于15%;
d、氧化钙与水反应生成氢氧化钙,氢氧化钙微溶于水,溶质的质量分数最小。

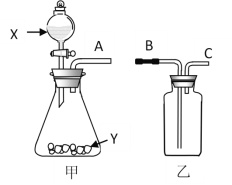
【题目】水与自然界中矿石长期接触,常含Ca(HCO3)2、Mg(HCO3)2等物质,导致钙离子、镁离子含量较多,称之为硬水。生活中,水的硬度过高会造成一定危害。长期使用硬水烧水的热水壶,内部会形成一层水垢,其主要成分为碳酸钙和氢氧化镁,说明加热煮沸可使这类硬水成为软水。其原理的流程如下、题(气体产物已略去):
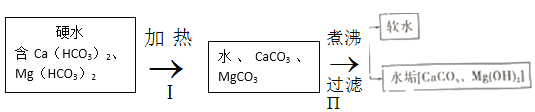
回答下列问题:
(1)反应Ⅰ属于四大基本反应类型中的________反应;反应Ⅱ除产生水垢外,还有一种气体产物为________;如果当地硬水中CaSO4含量较多,则水垢中还常含有少量CaSO4,CaSO4析出的原因是________。
(2)向200g水垢中加入400g过量的稀盐酸,充分反应,测得3分钟内混合物质量的变化(不考虑水与HCl的挥发)如下表所示:
时间/s(秒) | 0 | 30 | 60 | 90 | 120 | 180 |
混合物的质量/g | 600 | 574 | 554 | 547.2 | 547.2 | 547.2 |
①观察到的现象是____
②计算水垢中碳酸钙的质量分数____,写出必要的计算过程。
【题目】有镁和氯化镁固体混合物,取一定量的该混合物放入烧杯中,然后取稀盐酸200g,平均分五次加入其中,充分振荡,实验所得数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量/g | 40 | 40 | 40 | 40 | 40 |
生成气体的总质量/g | 0.16 | m | 0.48 | 0.5 | 0.5 |
(1)表中m的值为_____。
(2)所用稀盐酸的溶质质量分数为多少?____