题目内容
【题目】水与自然界中矿石长期接触,常含Ca(HCO3)2、Mg(HCO3)2等物质,导致钙离子、镁离子含量较多,称之为硬水。生活中,水的硬度过高会造成一定危害。长期使用硬水烧水的热水壶,内部会形成一层水垢,其主要成分为碳酸钙和氢氧化镁,说明加热煮沸可使这类硬水成为软水。其原理的流程如下、题(气体产物已略去):
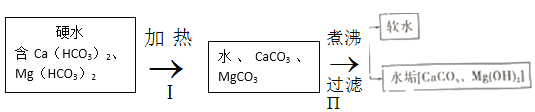
回答下列问题:
(1)反应Ⅰ属于四大基本反应类型中的________反应;反应Ⅱ除产生水垢外,还有一种气体产物为________;如果当地硬水中CaSO4含量较多,则水垢中还常含有少量CaSO4,CaSO4析出的原因是________。
(2)向200g水垢中加入400g过量的稀盐酸,充分反应,测得3分钟内混合物质量的变化(不考虑水与HCl的挥发)如下表所示:
时间/s(秒) | 0 | 30 | 60 | 90 | 120 | 180 |
混合物的质量/g | 600 | 574 | 554 | 547.2 | 547.2 | 547.2 |
①观察到的现象是____
②计算水垢中碳酸钙的质量分数____,写出必要的计算过程。
【答案】分解 二氧化碳 硫酸钙微溶,且温度升高溶解度降低 固体逐渐溶解,产生无色气体 60%
【解析】
(1)反应Ⅰ是碳酸氢钙和碳酸氢镁分解为碳酸钙和碳酸镁的同时,还生成二氧化碳和水,所以属于四大基本反应类型中的 分解反应;反应Ⅱ除产生水垢外,由于碳酸镁转化为了氢氧化镁,根据质量守恒定律可得,生成的气体产物为 二氧化碳;如果当地硬水中CaSO4含量较多,则水垢中还常含有少量CaSO4,CaSO4析出的原因是 硫酸钙微溶,且温度升高溶解度降低。故填:分解;二氧化碳;硫酸钙微溶,且温度升高溶解度降低
(2)①由于碳酸钙和盐酸反应生成二氧化碳,所以观察到的现象是 固体逐渐溶解,产生无色气体。故填:固体逐渐溶解,产生无色气体
②根据质量守恒定律可得,生成的二氧化碳的质量为600g-547.2g=52.8g
设水垢中碳酸钙的质量分数为x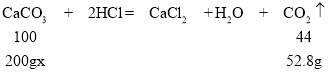
![]()
x=60%;故填:60%

【题目】以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | |
Na2CO3的溶解度(g/100g水) | 7.1 | 12.5 | 21.5 | 39.7 | 49.0 | 48.5 | 46.0 |
NaHCO3的溶解度(g/100g水) | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
A. 40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B. 60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C. 30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D. 20℃的饱和Na2CO3溶液中通足量CO2,生成的NaHCO3会部分析出
【题目】利用图所示装置(气密性良好)分别进行以下实验,最终U型管中两侧液面的相对高度不正确的是(加入试管中的试剂X所占体积忽略不计)
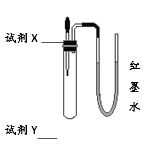
试剂X | 试剂Y | 相对高度 | |
A | 水 | 氧化钙(少量) | 左低右高 |
B | 过氧化氢溶液 | 二氧化锰(少量) | 左低右高 |
C | 稀盐酸 | 石灰石(少量) | 左低右高 |
D | 澄清石灰水 | 二氧化碳 | 左高右低 |
A. A B. B C. C D. D