题目内容
【题目】有实验室有一包白色粉末,可能含有![]() 和
和![]() 中的一种或几种,为了确定其成分,某化学兴趣小组进行了如下探究。
中的一种或几种,为了确定其成分,某化学兴趣小组进行了如下探究。
(查阅资料)![]() 固体不溶于水,也不溶于稀盐酸。
固体不溶于水,也不溶于稀盐酸。
(实验探究)
(1)甲同学设计了如下的实验方案。
实验步骤 | 实验现象 | 实验结论 |
a取少量该粉末于试管中,加入足量水充分溶解 | 有白色沉淀 | 有原粉末中一定含有 |
b将步骤a试管中物质过滤,向滤液中滴加酚酞溶液 | 溶液变红 | 原粉末一定含有_______ |
(2)乙同学认为甲同学步骤a的结论不一定正确,其理由是_______,他补充了如下实验,取白色沉淀于试管中,加入足量稀盐酸,观察到有气泡产生且_______,从而得出结论:步骤a中得到的白色沉淀全部是![]() ;
;
(3)丙同学取甲同学步骤b中已变红的溶液,向其中逐滴滴入稀硫酸,发现有白色沉淀生成且溶液褪色.根据有白色沉淀生成的现象确定原粉末中一定有________,一定没有________;溶液褪色的原因用化学方程式表示为_______。
(总结归纳)通过以上探究,原白色粉末中无法确定的成分是_______(填化学式)
【答案】NaOH ![]() 与
与![]() 反应也生成白色沉淀(合理即可) 沉淀全部溶解
反应也生成白色沉淀(合理即可) 沉淀全部溶解 ![]()
![]()
![]()
![]()
【解析】
步骤a加入水溶解有白色沉淀,就得出白色粉末含有碳酸钙的结论不正确,因白色沉淀也有可能是![]() 与
与![]() 生成的硫酸钡。而硫酸钡不溶于酸,故可用酸来判断白色沉淀的成分。向步骤b溶液中加稀硫酸发现有白色沉淀生成且溶液褪色,则白色沉淀为硫酸钡,肯定含有氯化钡,肯定没有硫酸钠,红色褪去是发生了中和反应。
生成的硫酸钡。而硫酸钡不溶于酸,故可用酸来判断白色沉淀的成分。向步骤b溶液中加稀硫酸发现有白色沉淀生成且溶液褪色,则白色沉淀为硫酸钡,肯定含有氯化钡,肯定没有硫酸钠,红色褪去是发生了中和反应。
由分析可知:
(1)粉末中一定含有氢氧化钠;
(2)步骤a的结论不正确,因为![]() 与
与![]() 反应也生成白色沉淀,加入足量稀盐酸,观察到有气泡产生且全部溶解则证明白色沉淀碳酸钙;
反应也生成白色沉淀,加入足量稀盐酸,观察到有气泡产生且全部溶解则证明白色沉淀碳酸钙;
(3)向步骤b溶液中加稀硫酸发现有白色沉淀生成且溶液褪色,白色沉淀为硫酸钡,则肯定含有氯化钡,肯定没有硫酸钠,红色褪去是发生了中和反应,反应化学方程式为:![]() ;
;
[总结归纳]整个探究过程氯化钠是否存在无法证明。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】溶液与人们的生活息息相关。
(l)下列少量物质分别放入水中,充分搅拌,可以得到溶液的是______(填字母)。
A高锰酸钾 B汽油 C面粉
(2)在盛有水的烧杯中加入以下某种物质,形成溶液过程中,温度升高。这种物质是______(填字母)。
A烧碱 B硝酸铵 C纯碱 D氯化钠
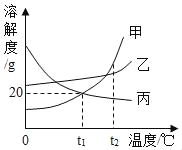
(3)下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①60℃时,氯化钠的溶解度_______硝酸钾的溶解度(填“>”“=”或“<”)。
②表中某物质的饱和溶液随温度升高析出固体,该物质是_______(填化学式)。
③20℃时,氯化钠饱和溶液中溶质的质量分数为________(结果保留至0.1%)。
④向20℃的氢氧化钙饱和溶液中加入少量生石灰,再冷却至20℃,此时溶液中溶质的质量比加入生石灰前溶液中溶质的质量____(填“增大”“不变”或“减小”)。
⑤混有少量氯化钠的硝酸钾固体,加水配成80℃的硝酸钾饱和溶液,再冷却至20℃,析出晶体并得到溶液。下列有关说法中正确的是_______(填字母)。
A析出的晶体中不一定含有硝酸钾
B所得溶液一定是硝酸钾饱和溶液
C上述方法可以将两种物质完全分离