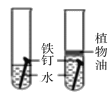
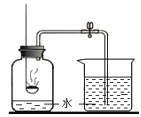
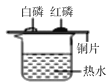
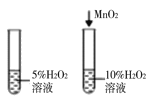
题目内容
【题目】取氯化钙和氯化钠的混合物10g,加入40g水使其完全溶解,再加入50g碳酸钠溶液恰好完全反应,过滤,得95g滤液(不考虑实验过程中质量损失),计算:
(1)所加碳酸钠溶液的溶质质量分数;
(2)反应后所得滤液中溶质的质量分数(计算结果精确到0.1%).
【答案】(1)10.6%;(2)10.8%
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了碳酸钙,所以可以求算碳酸钙的质量,根据碳酸钙和对应的化学方程式求算碳酸钠和生成氯化钠的质量,进而求算对应的质量分数.
(1)根据质量守恒定律可得,生成的碳酸钙的质量为10g+40g+50g﹣95g=5g
设碳酸钠的质量为x,样品中氯化钙的质量为y,生成的氯化钠的质量为z.
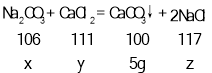
![]()
x=5.3g
y=5.55g
z=5.85g
碳酸钠溶液中碳酸钠的质量分数为![]() ×100%=10.6%
×100%=10.6%
(2)反应后所得溶液中氯化钠的质量分数为![]() ×100%≈10.8%
×100%≈10.8%
答:(1)所加碳酸钠溶液的溶质质量分数为10.6%;
(2)反应后所得滤液中溶质的质量分数约为10.8%.

【题目】有实验室有一包白色粉末,可能含有![]() 和
和![]() 中的一种或几种,为了确定其成分,某化学兴趣小组进行了如下探究。
中的一种或几种,为了确定其成分,某化学兴趣小组进行了如下探究。
(查阅资料)![]() 固体不溶于水,也不溶于稀盐酸。
固体不溶于水,也不溶于稀盐酸。
(实验探究)
(1)甲同学设计了如下的实验方案。
实验步骤 | 实验现象 | 实验结论 |
a取少量该粉末于试管中,加入足量水充分溶解 | 有白色沉淀 | 有原粉末中一定含有 |
b将步骤a试管中物质过滤,向滤液中滴加酚酞溶液 | 溶液变红 | 原粉末一定含有_______ |
(2)乙同学认为甲同学步骤a的结论不一定正确,其理由是_______,他补充了如下实验,取白色沉淀于试管中,加入足量稀盐酸,观察到有气泡产生且_______,从而得出结论:步骤a中得到的白色沉淀全部是![]() ;
;
(3)丙同学取甲同学步骤b中已变红的溶液,向其中逐滴滴入稀硫酸,发现有白色沉淀生成且溶液褪色.根据有白色沉淀生成的现象确定原粉末中一定有________,一定没有________;溶液褪色的原因用化学方程式表示为_______。
(总结归纳)通过以上探究,原白色粉末中无法确定的成分是_______(填化学式)
【题目】下列实验操作,能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 验证NaCl溶液中混有盐酸 | 取少量溶液,滴加无色酚酞溶液 |
B | 除去NaOH中混有的碳酸钠 | 滴加足量盐酸、蒸发 |
C | 比较Zn、Cu、Ag的金属活动性 | 将Zn和Ag分别放入CuSO4溶液中 |
D | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、蒸发 |
A.AB.BC.CD.D