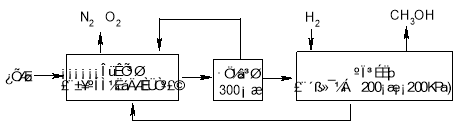
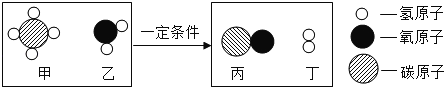
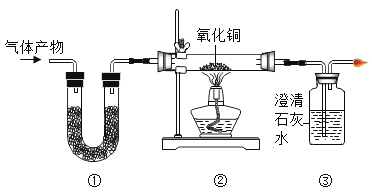
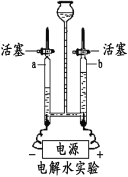
��Ŀ����
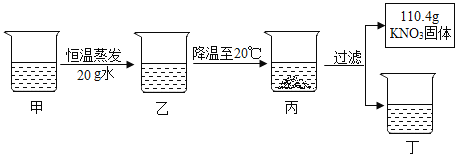
����Ŀ������80�溬��100gˮ��KNO3��Һ������������ͼ��ʾ��
��֪������ڲ�ͬ�¶��µ��ܽ�����±���
�¶�/�� | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
�ܽ��/g | 32 | 46 | 64 | 85.5 | 110 | 138 | 170 |
�����Ϲ��̵ķ�����������ǣ�������
A. �ס��ҡ�������������Һ�У�������Һֻ��2��
B. ���Ͷ���Һ�е�����������ͬ
C. ������Һ�У��������������Ĵ�С��ϵΪ�ң��ף�������
D. ���������Һֱ����ȴ���������壬��ʼ����������¶���60��70��֮��
���𰸡�A
��������
�ɱ������ݿ�֪������ص��ܽ�����¶ȵ����߶�����
A��20��ʱ������ص��ܽ����32g����100gˮ������ܽ�32g������80gˮ������ܽ����������Ϊ25.6g��������Һ�DZ�����Һ���Ѿ��������壬���˳�110.4g����أ����Լ���Һ�к�������ص�����Ϊ��110.4g+25.6g��136g��������80�溬��100gˮ��KNO3��Һ���ܽ����170g�����Լ��Dz�������Һ������20gˮ���õ��ң�����Һ�к���80gˮ����Ϊ80������ص��ܽ����170g������80gˮ����ܽ�136g���������ܽ���136g����������Һ�DZ�����Һ����������Һ��������������Һ���ڱ�����Һ����A����ȷ��
B������Һ�DZ���Һ���˵õ��ģ����Ա��Ͷ���Һ�е�����������ͬ����B��ȷ��
C������Һ����20gˮ�õ��ң��ס�������������ȣ���������Һ�����������������ڼף������������õ����������˵õ��ң�����������Һ�У��������������Ĵ�С��ϵΪ�ң��ף�����������C��ȷ��
D��������Һ������������136g���������������Һֱ����ȴ���������壬��ʼ����������¶���60��70��֮�䣬��D��ȷ����ѡA��

����Ŀ����ѧ���츣����Ŀ�ѧ����������ѧ֪ʶ�ش��������⡣
(1)���Ͳ������Ź㷺��Ӧ�á�
Ӧ�� | ������������DZ�� | ������������Ա����� | ����ˮ������ |
�õ��IJ��� | ���ָ� | ��ǿ�ȵ��� | �������� |
�����������������л��ϳɲ��ϵ���______��
������������������ˮ�е�ijЩ��Ⱦ���������ķ�ˮ�����������˿�ȥ����Ⱦ�
��������Ҳ�������������о�ˮ���õ���______(����ĸ)
a����ʯ�� b������̿ c������
(2)��Һ�����ǵ���������������أ�ͼIΪ�ס��ҡ������ֹ������ʵ��ܽ�����ߡ�
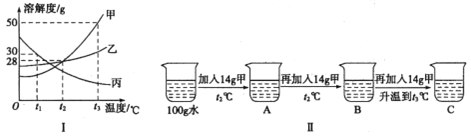
��t1��ʱ�ס��ҡ����������ʵ��ܽ���ɴ�С��˳����______��
��ijͬѧ��ͼ����ʾ����ʵ�飬�õ���Ӧ�¶��µ�A��B��C������Һ���������ڱ�����Һ����______(����ĸ)��
��t3��ʱ��ʢ��40g�����ʵ��ձ��м���50gˮ����ܽ��������Һ���ʵ���������Ϊ______��(�����ȷ��0.1%)
����Ŀ����ȤС���ͬѧѧϰ��̼���Ƶ����ʺ�̼�����Ƶ�����Ҳ����̽����
������1��̼��������Һ��̼������Һ�������
��ʵ��1����pH��ֽ�ⶨ��Ũ�ȵ�̼�����ƺ�̼������Һ��pH���ֱ�Ϊ9��12��
������1��������Һ���ʼ��ԣ����ǵļ���ǿ��˳��Ϊ_____��
������2��̼��������Һ��̼������Һ����ķ�Ӧ
��ʵ��2����Ũ�ȵ�̼�����ƺ�̼������Һ�ֱ�����ͬŨ�ȵ����ᷴӦ
�������������±���
��� | ���� | ���� |
ʵ���� | ̼��������Һ��μ��������� | ���̲������� |
ʵ���� | ̼������Һ��μ��������� | ���̲������� |
ʵ���� | ������μ���̼��������Һ�� | ���̲������� |
ʵ���� | ������μ�����̼������Һ�� | �μ�һ���������ݲ��� |
������3��ʵ�������������ʵ������ͬ��ԭ��
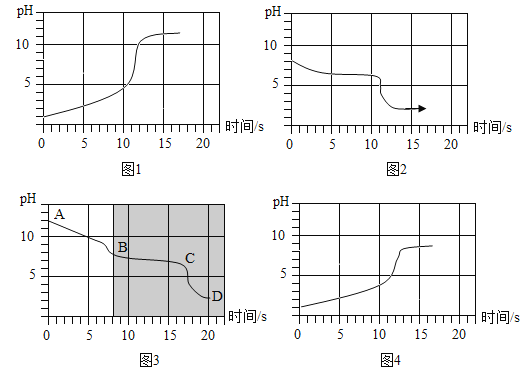
��ʵ��3������Ũ�ȵ�̼�����ƺ�̼������Һ����ͬŨ�ȵ����ụ�Σ������ֳִ������ⶨ��Ӧ����ҺpH�仯���ĸ�ʵ���pH�仯��ʱ��Ĺ�ϵ��ͼ��ʾ��
��������
��1����ͼ��ʾ��ʵ����_____����ʵ��2�е���ţ���
��2���Ƚ���ͼ����ͼ���֣���ͼ�е���Ӱ��������ͼ���Ϻ�ͼ������غϡ�
����ͼ�е�AB�η�����Ӧ�Ļ�ѧ����ʽΪ_____��BC�η�����Ӧ�Ļ�ѧ����ʽΪ_____��D�������Ϊ_____��д��ѧʽ�������ԣ���������μ���̼������Һ�У��μ�һ���������ݲ�������ԭ����_____��
��3���Ƚ���ͼ����ͼ���֣���ͬ�IJ����в�ͬ�����Է��������һ�����ԭ��_____��
��Ӧ�ã�
��ϡ����������һƿ��Һ���������ƻ���̼����ʱ��Ӧ��β����� _____��