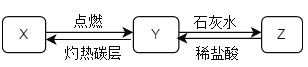
��Ŀ����
����Ŀ����֪��Na2OΪ��ɫ��Na2O2Ϊ����ɫ��Na2O+H2O=2NaOH��ij��ȤС����ƺ�ͭ�ĵ��ʼ��仯��������ʽ���������ʵ��̽����
�ٽ�ͭƬ��������̨����Ȧ�ϣ��þƾ��Ƽ��ȣ��۲쵽ͭƬ�����ڣ�
�ڳ��Ƚ�������ͭƬ���棬�ƾ���ȼ�գ��е���ɫ�������ɣ����˵���ɫ����ת�Ƶ��Թ��д��ã���������ˮ��ϴͭƬ���۲쵽ͭƬ����ȼ�մ������˹�����ͭ�ߣ�
����ʢװ����ɫ���ʵ��Թ��еμ�����ˮ���۲쵽ð���ݣ��������ǵ�ľ�������Թܣ�ľ����ȼ��
�ش��������⣺
(1)����ٲ����ĺ�ɫ������________������ڵ���ɫ��������Ԫ�صĻ��ϼ�Ϊ________�ۡ�
(2)������в���ͭ�߷�Ӧ����һ�����һ����������ӦҲת��Ϊ����ɫ���ʣ������ͭ�߷�Ӧ�Ļ�ѧ����ʽΪ________��
(3)����۲�������������Ϊ________��
(4)���벽��ۻ�������һ�ֳ�������________(�ѧʽ)���ɣ���Ӧ�����Һ�еμ�________��Һ(�ɹ�ѡ����Լ���H2SO4��CuSO4��KOH��Na2CO3)���۲쵽________������ʱ����֤������IJ��롣
���𰸡�����ͭ -1 CuO+2Na![]() Cu+Na2O ���� NaOH CuSO4 ������ɫ����
Cu+Na2O ���� NaOH CuSO4 ������ɫ����
��������
(1)��ͭƬ��������̨����Ȧ�ϣ��þƾ��Ƽ��ȣ�ͭ�������ڼ�����������������ͭ������ٲ����ĺ�ɫ����������ͭ������ڵ���ɫ������Na2O2����Ԫ����+1�ۣ�����Ԫ�صĻ��ϼ���x�������ڻ��������������ϼ۴�����Ϊ�㣬�ɵã�(+1)��2+2x=0����x=-1�ۡ��������ͭ��-1
(2)ͭƬ����ȼ�մ������˹�����ͭ�ߣ�����Ϊ����ͭ�����ڼ�������������ͭ�������ƣ���Ӧ�Ļ�ѧ����ʽΪCuO+2Na![]() Cu+Na2O�����CuO+2Na
Cu+Na2O�����CuO+2Na![]() Cu+Na2O��
Cu+Na2O��
(3)�������ǵ�ľ�������Թܣ�ľ����ȼ��˵���������������������������
(4)�������غ㶨�ɣ���Ӧǰ��Ԫ������䣬����ۻ�������һ�ֳ����������������ƣ�����������������ͭ��Һ��Ӧ����������ͭ��ɫ��������۲쵽������ɫ������֤��������ȷ�����NaOH��CuSO4��������ɫ����

����Ŀ��ũҵ�ϳ��ñ���ʳ��ˮ����ѡ�֣�С��������ijŨ�ȵ��Ȼ�����Һ50kg��Ϊ��ȷ�����Ȼ�����Һ��Ũ�ȣ�С��ȡ��70�˸���Һ����ʵ�飬�õ���������
����ˮ������/g | 10 | 20 | 30 | 40 | 50 |
��ȴ������ʱ�����Ȼ��Ƶ�����/g | 0 | 0 | 0 | 2.8 | 6.4 |
��1��ԭ��Һ���Ȼ��Ƶ�����������
��2����50kg�Ȼ�����Һ�м������ǧ���Ȼ��Ƹպó�Ϊ������ʱ�ı�����Һ��
����Ŀ��ˮ�ǵ��������������֮һ��Ҳ��ʵ���ҳ��õ��Լ�����ͼ��ʾʵ���ж��õ�ˮ��
|
|
|
|
ͼһ | ͼ�� | ͼ�� | ͼ�� |
�й�˵����ȷ���ǣ� ��
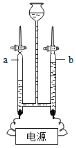
A. ��ͼ��ʾʵ������о������˻�ѧ�仯
B. ͼ1ʵ����ط�Ӧ��Ԫ�صĻ��ϼ۾������˸ı䣬b���ڵ��������ȼ��
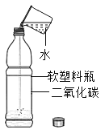
C. ͼ2ʵ�����ƿ����������ƿ�������Һ���pHС��7
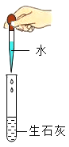
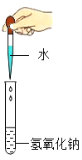
D. ͼ3��ͼ4ʵ���������ˮ���ȣ�����Һ�����ʹ��ɫʯ����Һ���
����Ŀ������80�溬��100gˮ��KNO3��Һ������������ͼ��ʾ��
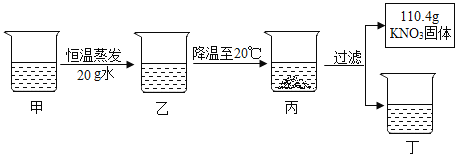
��֪������ڲ�ͬ�¶��µ��ܽ�����±���
�¶�/�� | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
�ܽ��/g | 32 | 46 | 64 | 85.5 | 110 | 138 | 170 |
�����Ϲ��̵ķ�����������ǣ�������
A. �ס��ҡ�������������Һ�У�������Һֻ��2��
B. ���Ͷ���Һ�е�����������ͬ
C. ������Һ�У��������������Ĵ�С��ϵΪ�ң��ף�������
D. ���������Һֱ����ȴ���������壬��ʼ����������¶���60��70��֮��