题目内容
【题目】(7分)某化肥KNO3样品在运输存放过程中可能混进了NH4NO3、NH4HCO3、KCl三种物质中的一种或几种,现按如图所示进行检验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全进行)。试根据实验过程和发生的现象回答下列问题:
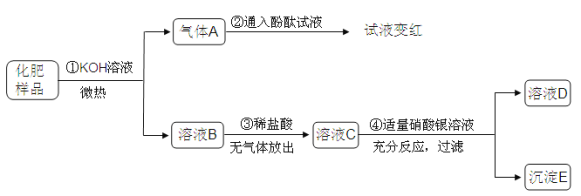
(1)气体A的气味为 。
(2)实验步骤③的现象说明化肥中一定不含有的物质是 。
(3)实验证明,溶液D中一定存在的溶质是(写化学式) 。
(4)实验过程①中发生反应的化学方程式为 。
(5)实验步骤④的现象 (填“能”或“不能”)证明KCl一定混进了化肥中,请说明判断理由 ;
为进一步确定其存在,可以对以上实验进行改动,具体做法是
。
【答案】(1)刺激性 (2)NH4HCO3 (3)KNO3 HNO3
(4) NH4NO3 + KOH ===KNO3 + NH3 ↑+ H2O
(5)不能 因为在实验③中加入稀盐酸,引入了Cl- 应将③中的稀盐酸改为稀硝酸
【解析】
试题分析:此题属于叙述实验型框图推断题,解题时,要紧跟实验步骤,抓住特征现象,比如:特征颜色、特征离子的检验等,在固体中加入KOH溶液,产生一种气体A,将气体通入酚酞溶液中,试液变红,结合白色固体中的物质成分,可判断可能含有NH4HCO3或NH4NO3,无色气体A为氨气,在无色滤液B中加入吸烟酸稀盐酸,无气体放出,可以判断原固体中一定不含NH4HCO3,一定含NH4NO3,在沉淀C中加入稀盐酸,得到蓝绿色溶液,说明原固体中含有CuO
(1)无色气体A为氨气,有刺激性气味
(2)实验步骤③的现象说明化肥中一定不含有的物质是NH4HCO3
(3)经过上面的分析,固体中一定含有KNO3和NH4NO3,故在实验①中发生的反应是:KOH+NH4NO3==KNO3+NH3↑+H2O,而在实验④发生的反应是:HCl+AgNO3==AgCl↓+HNO3,所以溶液D中一定存在的溶质是:KNO3 和HNO3
(4)实验过程①中发生反应的化学方程式为:NH4NO3 + KOH ===KNO3 + NH3 ↑+ H2O
(5)实验步骤④的现象不能证明KCl一定混进了化肥中,原因是:因为在③中加入稀盐酸,引入了Cl-,为进一步确定其存在,可以对以上实验进行改动,具体做法是:应将③中的稀盐酸改为稀硝酸

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】(6分)课外活动时,同学们采用以下两种方法测定某氯化钠溶液的溶质质量分数。
(1)【化学方法】向一定量氯化钠溶液中加入足量硝酸银溶液,得到2.87g氯化银固体,则该氯化钠溶液中氯化钠的质量为多少?(根据化学方程式列式计算)
经多次实验测定,该溶液的溶质质量分数为10%。
(2)【物理方法】取一定量该溶液进行蒸发,测量实验数据如下:
蒸发皿的质量(g) | 25.0 |
蒸发皿+食盐溶液(g) | 45.0 |
蒸发皿+食盐晶体(g) | 27.4 |
数据处理 | 溶液的溶质质量分数为 |
若化学方法测定结果准确,则物理方法测定结果产生误差的原因是
A.蒸发时未用玻璃棒搅拌 B.所取氯化钠溶液质量较大
C.蒸发时出现少量晶体时就停止加热 D.实验后未将玻璃棒上的白色固体移入蒸发皿
【题目】有一包黑色粉末,可能由C、CuO、Fe三种物质中的一种或几种组成。某化学兴趣小组为了探究它的成分,按如下步骤进行实验。
(1)先对实验做了如下设想和分析:黑粉中只有碳粉不溶解于稀盐酸。取少量粉末于烧杯中,向烧杯中加入过量的稀硫酸,则实验中可能出现的现象与对应结论如下表所示(表中未列完所有情况)。请你完成下表。
烧杯中可能出现的现象 | 结论 |
① | 只含C |
②固体部分溶解,溶液变成蓝色,无气泡 | |
③有黑色不溶物,有气泡逸出,溶液呈浅绿色 | 含C、Fe |
(2)通过实验及分析,确定该粉末为C、CuO的混合物。为了进一步探究C、CuO的性质,他们又利用这种混合物补充做了下面两个实验。
【实验一】将此粉末敞口在空气中灼烧完全,待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置。烧杯中 (填“有”或“无”)不溶物,溶液呈 色。
【实验二】将此粉末隔绝空气加热(若碳完全反应),待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置。请回答:①烧杯中 (填“有”或“无”)不溶物;②若静置后溶液呈无色,则该溶液中溶质是 (写化学式);③若静置后溶液呈蓝色,该实验过程中所发生反应的化学方程式 、 。