题目内容
【题目】化学是一门以实验为基础的学科。
【实验一】常见气体的制取
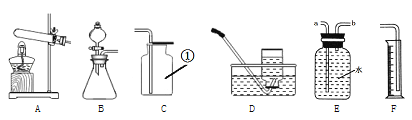
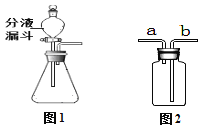
(1)若用图1装置制取氧气,则装置中发生反应的化学方程式是__________________.
(2)若用图1装置制取二氧化碳,则在锥形瓶中盛放______(填名称),装置中发生反应的化学方程式是____________.
【实验二】图2装置有多种用途
(3)收集气体:排空气法收集气体,气体从a端进入,该气体必须具有的性质是____.
(4)干燥气体:除去二氧化碳中的水蒸气,则装置中应盛放________(填“浓硫酸”或“NaOH溶液”)。
(5)贮存气体:用水将瓶中贮存的气体排出使用,水从___(填“a”或“b”)端进入。
【实验三】控制变量法是实验探究的重要方法
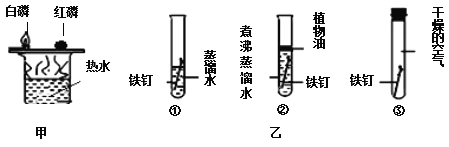
(6)上图甲中比较铜片上白磷和红磷的不同现象可以说明可燃物燃烧需要________。
(7)上图乙中①②③对比可以探究铁的锈蚀与_______、_____有关。
【答案】 2H2O2 MnO2 2H2O +O2↑ 石灰石或大理石(“碳酸钙”不得分); CaCO3+2HCl==CaCl2+H2O+CO2↑ 密度比空气小 浓硫酸 b 温度达到可燃物的着火点(无“温度”不得分) 氧气、 水
【解析】根据所学知识和题中信息知,【实验一】常见气体的制取。(1)若用图1装置制取氧气,固体和液体或液体和液体反应,不需加热制取气体,则装置中发生反应的化学方程式是2H2O2 ![]() 2H2O +O2↑。(2)若用图1装置制取二氧化碳,则在锥形瓶中盛放石灰石或大理石,装置中发生反应的化学方程式是CaCO3+2HCl==CaCl2+H2O+CO2↑。【实验二】图2装置有多种用途。(3)收集气体:排空气法收集气体,气体从a端进入,a端导管伸出较短,b端导管伸出较长,该气体必须具有的性质是密度比空气小。(4)干燥气体:除去二氧化碳中的水蒸气,则装置中应盛放浓硫酸,浓硫酸具有吸水性,并且不与二氧化碳反应。5)贮存气体:用水将瓶中贮存的气体排出使用,水从b端进入。【实验三】控制变量法是实验探究的重要方法。(6)甲中比较铜片上白磷和红磷的不同现象可以说明可燃物燃烧需要温度达到可燃物的着火点。(7)乙中①②③对比可以探究铁的锈蚀与氧气、水有关。
2H2O +O2↑。(2)若用图1装置制取二氧化碳,则在锥形瓶中盛放石灰石或大理石,装置中发生反应的化学方程式是CaCO3+2HCl==CaCl2+H2O+CO2↑。【实验二】图2装置有多种用途。(3)收集气体:排空气法收集气体,气体从a端进入,a端导管伸出较短,b端导管伸出较长,该气体必须具有的性质是密度比空气小。(4)干燥气体:除去二氧化碳中的水蒸气,则装置中应盛放浓硫酸,浓硫酸具有吸水性,并且不与二氧化碳反应。5)贮存气体:用水将瓶中贮存的气体排出使用,水从b端进入。【实验三】控制变量法是实验探究的重要方法。(6)甲中比较铜片上白磷和红磷的不同现象可以说明可燃物燃烧需要温度达到可燃物的着火点。(7)乙中①②③对比可以探究铁的锈蚀与氧气、水有关。
点睛∶燃烧需要同时满足两个条件⑴可燃物与空气接触⑵温度达到可燃物的着火点。根据反应物状态和反应条件选择气体制取装置,根据生成气体的溶解性和密度选择气体的收集方法。

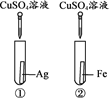
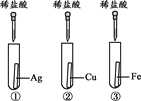
【题目】为探究铁、铜、银三种金属的活动性顺序,设计了A、B两个方案。
方案A | 方案B |
|
|
(1)能验证三种金属活动性顺序的方案是________(填“A”或“B”)。
(2)方案B中,证明铁的活动性比铜强的现象是___________。
【题目】化学兴趣小组的同学欲测定实验室中某黄铜(铜锌合金)样品中铜的质量分数(不考虑黄铜中的其他杂质,请你参与他们的探究过程。称量10 g粉末状黄铜样品放入烧杯中,量取45 mL稀盐酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(mL) | 15 | 15 | 15 |
生成氢气的质量(g) | 0.04 | m | 0.02 |
试求:
(1)求m的数值。m=_________
(2)求此黄铜样品中铜的质量分数________。
【题目】同学们对制作糕点常用膨松剂Na2CO3或NaHCO3进行了下列探究。
【查阅资料】
溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
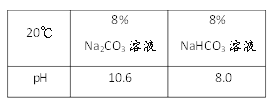
【探究一】NaHCO3和Na2CO3性质差异的探究
(1)现有20℃时溶质质量分数为8%的Na2CO3和NaHCO3溶液酸碱性:取样于试管中,分别滴加紫色石蕊试液,均显_____色;酸碱度:NaHCO3溶液________Na2CO3溶液(填“>”或”“<”)。
(2)稳定性:按下图,实验中可观察乙烧杯中的石灰水变浑浊,甲烧杯不变,则乙烧杯中发生反应的化学方程式为:___________________________。结论:在受热条件下,碳酸钠比碳酸氢钠稳定性______(填“强”或“弱”)。
(3)利用溶解度鉴别NaHCO3和Na2CO3:分别取Xg两种固体粉末加入20℃,10g水中充分溶解,通过观察溶解现象来区分,X可以是下列的_______。(选填A、B或C)
A.1.5g B.0.96g C.0.5g
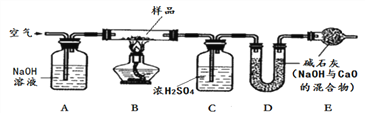
【探究二】测定NaHCO3和Na2CO3混合物10.0g中NaHCO3的质量分数(下图,夹持装置略)
【问题讨论】
(4)实验前先通一段时间的空气的目的是____________________;
(5)A的作用是_____________________________,若没有装置E,NaHCO3的质量分数测定结果会_____________(填“偏大”、“不变”或“偏小”)。
(6)停止加热后,仍继续通入空气一段时间,目的是___________________。
【含量测定】
(7)测得装置D的质量实验前为120.2g,实验后为122.4g,计算该样品中NaHCO3的质量分数。(要有计算过程)______________________
【知识拓展】
(8)向饱和的氯化钠溶液中通入氨气和二氧化碳,经过一系列变化,也可制得Na2CO3和一种铵盐。该反应的化学反应方程式为:_______________________。