题目内容
某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如图:
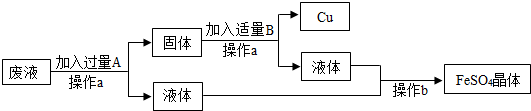
(1)操作a的名称是 .
(2)加入过量A的目的是 .
(3)写出流程中有关反应的化学方程式: 、 .

(1)操作a的名称是
(2)加入过量A的目的是
(3)写出流程中有关反应的化学方程式:
考点:金属的化学性质,过滤的原理、方法及其应用,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:在金属活动性顺序中,氢前的金属能与酸反应生成盐和氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,故要回收铜得到硫酸亚铁,可以加入铁;铁能溶解于酸,所以加稀硫酸可除去铜中的铁.然后据此解题.
解答:解:(1)经过操作a能得到固体和液体,故a操作为过滤;
(2)铁的金属性比铜强,可置换出硫酸铜中的铜,为使硫酸铜全部反应必须加过量的铁;
(3)铁的金属性比铜强,可置换出硫酸铜中的铜,过量的铁能溶解于酸,所以加稀硫酸可除去铜中的铁,因此发生的反应有:Fe+CuSO4═FeSO4+Cu; Fe+H2SO4═FeSO4+H2↑;
故答案为;(1)过滤;(2)使CuSO4全部反应;(3)Fe+CuSO4═FeSO4+Cu; Fe+H2SO4═FeSO4+H2↑.
(2)铁的金属性比铜强,可置换出硫酸铜中的铜,为使硫酸铜全部反应必须加过量的铁;
(3)铁的金属性比铜强,可置换出硫酸铜中的铜,过量的铁能溶解于酸,所以加稀硫酸可除去铜中的铁,因此发生的反应有:Fe+CuSO4═FeSO4+Cu; Fe+H2SO4═FeSO4+H2↑;
故答案为;(1)过滤;(2)使CuSO4全部反应;(3)Fe+CuSO4═FeSO4+Cu; Fe+H2SO4═FeSO4+H2↑.
点评:本题考查了铜的回收,完成此题,可以依据金属活动性顺序及其意义进行分析并写出反应的方程式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
向硝酸银和硝酸镁的混合溶液中加入一定量锌粉和铁粉的混合物,充分反应后过滤,得滤渣和滤液,向滤液中加入适量的稀盐酸,无沉淀出现,则下列说法中正确的是( )
| A、滤渣中一定有银、铁,可能有锌,滤液中一定有Mg2+、Zn2+,可能有Fe2+ |
| B、滤渣中一定有银、铁,可能有锌,滤液中一定有Mg2+、Zn2+、Fe2+,可能有Ag+ |
| C、滤渣中一定有银,可能有锌、铁,滤液中一定有Mg2+、Zn2+,可能有Fe2+ |
| D、滤渣中一定有银,可能有锌、铁,滤液中一定有Mg2+、,可能有Zn2+、Fe2+、Ag+ |
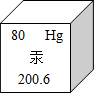 2014年1月18日,我国最大节能灯管产地浙江临安遭汞污染,如图为汞元素周期表中的一格,下列有关说法不正确的是( )
2014年1月18日,我国最大节能灯管产地浙江临安遭汞污染,如图为汞元素周期表中的一格,下列有关说法不正确的是( )| A、该元素的原子序数为80 |
| B、该元素的相对原子质量为200.6 |
| C、该元素的原子核外有80个电子 |
| D、体温计中的汞柱随温度的升高而上升,是因为温度越高汞原子体积越大 |
 如图是市售某牙膏的部分说明.其主要成分是单氟磷酸钠(Na2PO3F),它是牙膏的常用添加剂,实验表明,单氟磷酸钠的质量分数达到0.76%--0.80%时,防龋齿效果较好.(②③小题计算结果精确到0.01%)
如图是市售某牙膏的部分说明.其主要成分是单氟磷酸钠(Na2PO3F),它是牙膏的常用添加剂,实验表明,单氟磷酸钠的质量分数达到0.76%--0.80%时,防龋齿效果较好.(②③小题计算结果精确到0.01%)