题目内容
【题目】有一种工业废水,其中含有大量的硫酸亚铁、少量的硫酸铜以及污泥。某同学设计了一个既经济又合理的方法回收铜和硫酸亚铁晶体,方案流程如下,请回答:
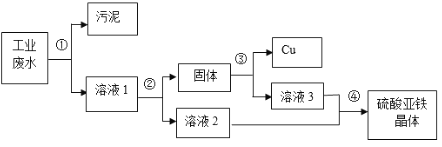
(1)步骤①②③中最后都需进行的实验操作是_____.
(2)步骤②中需加入的物质是_____(填化学式),所得固体的成分有_____种.
(3)溶液1的质量_____(填“大于”“小于”或“等于”)溶液2的质量。
【答案】过滤 Fe 2 大于
【解析】
(1)步骤①②③均是使固体与液体分离,最后都需进行的实验操作是过滤。
(2)步骤②中过量的铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,能得到铜和硫酸亚铁;所得固体为铁和铜的混合物,所得固体的成分有2种。
(3)铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,参加反应的铁的相对原子质量小于生成铜的质量,由质量守恒定律,溶液1的质量大于溶液2的质量。
故答案为:
(1)过滤;
(2)Fe,2;
(3)大于。

【题目】学习氢氧化钠的性质时,老师为了让同学们看到CO2与氢氧化钠反应有明显现象,设计了演示实验:给集满CO2的烧瓶中加入浓的氢氧化钠溶液,然后迅速盖上并塞紧带有玻璃管的胶塞,玻璃管下端套有一气球(如图)。振荡烧瓶后,可看到的现象是_____,原因是_____。写出该反应的化学方程式:_____。
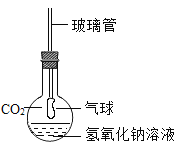
可是细心的小明同学发现,经老师用力振荡后烧瓶内液体呈白色浑浊!好学的小明同学很想知道白色浑浊是什么物质,为此他进行了以下的探究活动:
[查阅资料](1)在氢氧化钠溶液中通入过量的二氧化碳会生成碳酸氢钠,该反应的化学方程式为:NaOH+ CO2 +H2O = NaHCO3;
(2)常温下,NaHCO3在水中的溶解度比Na2CO3小。Na2CO3过饱和后也会结晶析出。
(3)Ca(HCO3)2 可溶于水。
[猜想]猜想一:该白色浑浊物中只有Na2CO3 ;猜想二:该白色浑浊物中只有NaHCO3;猜想三:该白色浑浊物中可能有_____。
[实验探究]
设计实验验证猜想:小明同学根据老师的提示将该浑浊液体加水搅拌后发现白色浑浊消失形成无色溶液!这些神奇的变化让小明更加好奇,他于是又设计了以下实验来验证其猜想:
实验步骤 | 实验现象 | 结论 |
①取少量加水后形成的无色溶液,加入过量CaCl2溶液,静置。 | _____ | 该溶液中_____ |
②再取步骤①的上层清液,加入_____。 | _____ | 证明该溶液中_____ |
小明通过努力终于明白了二氧化碳与氢氧化钠溶液反应后液体出现白色浑浊的原因。请你通过以上实验现象分析说出小明完成本实验的最后结论是:猜想_____正确。