题目内容
【题目】某化合物6.4g与一定量的氧气反应,生成8.8g二氧化碳、5.6g一氧化碳和14.4g水,该反应中消耗的氧气质量为_____g,该化合物的化学式为_____。
【答案】22.4 CH4
【解析】
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之,且化学反应前后元素种类和质量不变.
根据质量守恒定律可知,反应的氧气质量为![]() 。
。
8.8g二氧化碳中碳元素的质量为![]() ,氧元素的质量为
,氧元素的质量为![]() ;
;
5.6g一氧化碳中碳元素的质量为![]() ,氧元素的质量为
,氧元素的质量为![]() ;
;
14.4g水中氢元素的质量为![]() ,氧元素的质量为
,氧元素的质量为![]() ;该物质中氧元素的质量为
;该物质中氧元素的质量为![]() ; 该物质中,碳元素、氢元素质量分别是4.8g和1.6g,碳原子、氢原子的个数比为1:4,即该物质的化学式是CH4。
; 该物质中,碳元素、氢元素质量分别是4.8g和1.6g,碳原子、氢原子的个数比为1:4,即该物质的化学式是CH4。

练习册系列答案
相关题目
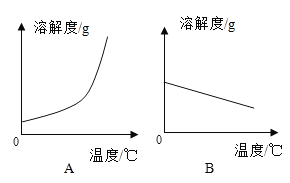
【题目】下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,如图中能表示NaOH溶解度曲线的是__________(填“A”或“B”)。
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,可采取措施有__________(填序号)。
①蒸发水;②升高温度;③降低温度;④加入水;⑤加入氢氧化钙。
(3)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后恢复20℃,得到乙溶液,溶液中溶质的质量分数的关系为甲________乙(填“>”、“<”或“=”)。