题目内容
【题目】研究和控制化学反应条件有重要意义。
(1)同学们想探究过氧化氢的浓度对反应速率的影响。在其他条件相同的情况下进行了三次实验,记录各收集一瓶相同体积氧气所需要的时间。
实验 | 30%双氧水 的质量(g) | 加入的水 的体积(mL) | 二氧化锰质量(g) | 收集时间(s) |
1 | 10 | 20 | 5 | 200 |
2 | 20 | 20 | 5 | 100 |
3 | 30 | 20 | ______________ | 67 |
①取用二氧化锰的仪器是 ______。
②二氧化锰在过氧化氢的分解中起_________作用。
③实验3中,加入的二氧化锰质量为_________g。
④相同条件下,实验3产生氧气的速率最快,说明_________。
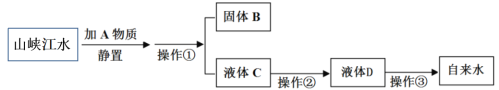
(2)同学通过查阅资料得知,过氧化氢在70℃以上会较快分解产生氧气。为了验证加热过氧化氢也可以产生氧气,同学们选择右图装置(气密性良好)进行实验。实验中观察试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是___________,同学分析原因后,采用了______法收集气体,再检验,证明加热双氧水也可产生氧气。
【答案】药匙 催化 5 过氧化氢溶液浓度越大,其分解的速率越快 加热水分蒸发加快,收集的氧气中含有大量的水蒸气,使氧气纯度降低 排水
【解析】
(1)①向试管中加入粉末状固体时,应将试管横放,用药匙或纸槽将固体放在试管底,然后将试管竖起,使固体滑到试管底;二氧化锰是固体粉末,取用时要用药匙; ②二氧化锰是过氧化氢分解常用的催化剂,能加快过氧化氢的分解速率,催化剂的作用叫催化作用;实验探究双氧水的溶质质量分数对反应速率的影响。所以在其他条件相同的情况下进行了三次实验,所以实验3中,根据控制变量原则,加入的二氧化锰质量为5g;
(2)通过查阅资料得知,过氧化氢在70℃以上会较快分解产生氧气。为了验证加热过氧化氢也可以产生氧气,选择装置(气密性良好)进行实验。实验中观察试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是加热水分蒸发加快,收集的氧气中含有大量的水蒸气,使氧气纯度降低,同学分析原因后,采用了排水法收集气体,使混在氧气中的水蒸气被冷凝,使收集的氧气较纯,再检验,带火星的木条复燃,证明加热双氧水也可产生氧气。

【题目】根据下列实验装置图,回答问题:
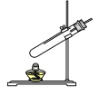
(1)写出上图所示装置中标有序号的仪器名称:①_______________ ② ______________。
(2)实验室用过氧化氢溶液和二氧化锰混合制取氧气,所选用的发生装置是________(选填装置序号,下同),请写出符号表达式:______________________,二氧化锰在该反应中的作用是_________。 若用F装置收集氧气,则验满的方法为____________________。
(3)甲烷是一种无色无味、难溶于水、密度比空气小的气体,实验室常用加热无水醋酸钠和碱石灰的固体混合物制取甲烷时,发生装置应选_________,若要收集一瓶干燥的甲烷气体,收集装置可选用____________(在“C、D、E”中选择)。
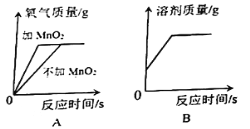
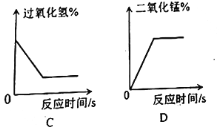
(4)下列图像表示在用过氧化氢溶液和二氧化锰的混合制取氧气的过程中某些量的变化趋势,其中能正确反应变化关系的是________ 。
(5)走进实验室,寻找新的催化剂。
(提出问题)红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
(实验探究)
实验步骤 | 实验现象 | 实验结论及解释 | |
I |
| A中无明显现象,B中产生大量能使带火星木条复燃的气体。 | 红砖粉能改变过氧化氢分解速率 |
II | B试管中重新加入5%的过氧化氢溶液,反应停止后,过滤分离出红砖粉,洗涤、干燥、称量 | B试管又产生大量能使带火星木条复燃的气体,滤渣的质量等于ag | 红砖粉末的____________在反应前后均没发生变化,能作为过氧化氢分解的催化剂。 |
III |
| 两支试管中均产生气泡,且___________________________________________。 | 红砖粉末的催化效果没有二氧化锰粉末好。 |
(拓展应用)
①实验中用到溶质质量分数为5%的过氧化氢溶液,若用10g溶质质量分数为30%的过氧化氢溶液来配制,加水的体积为____________mL。
②已知硫酸铜也可以作为过氧化氢分解的催化剂,向101.2g一定溶质质量分数的过氧化氢溶液中加入2g硫酸铜粉末。充分反应后得到溶质质量分数为2%的溶液,则生成氧气 _____g。