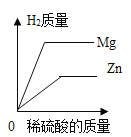
题目内容
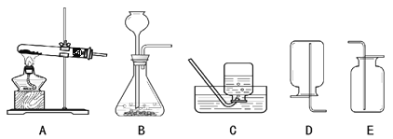
【题目】我国著名化学家侯德榜先生发明的侯氏制碱法,因原料利用率高,并能进行连续生产,从而享誉中外。某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如下图所示一套实验装置。
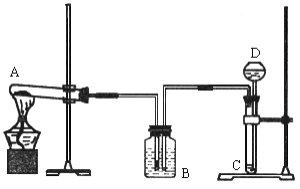
实验室可供选用的药品有:浓氨水、纯碱、大理石、稀盐酸、稀硫酸、熟石灰、氯化
铵、氯化钠。
(1)A、D 中最合适的试剂为:A_______,D_______(填名称)。
(2)本实验在具体操作过程中,应先通______气体,再通______气体,原因是_______。
(3)小红同学认为实验装置中存在某些不足,请指出其中的一处错误_________。
(4)在改进装置后,小丽同学进行了实验,实验所用的饱和氯化钠溶液中含溶质 58.5g,实验最后得到无水碳酸钠 26.0g,针对实验结果,该同学认真分析了造成损失的原因,发现其操作步骤并没有错误,则主要原因是___________。
【答案】氯化铵和熟石灰 稀盐酸 NH3 CO2 CO2在水中溶解度小,先通NH3至饱和,有利于NaHCO3析出 BC之间缺少止水夹 NaHCO3在水中有较大的溶解度,未能全部沉淀出来
【解析】
(1)试剂A用于制取氨气,可以选用氯化铵和熟石灰;试剂D与大理石反应制取二氧化碳气体,则试剂D为稀盐酸,
(2)CO2在水中溶解度小,氨气极易溶于水,则先通NH3至饱和,然后通入二氧化碳气体,有利于NaHCO3析出,
(3)根据图示装置可知,该装置的错误有:BC之间缺少止水夹、B装置应与大气相通、通NH3的导管不应伸入液面以下,
(4)如果操作正确,若碳酸氢钠的溶解度较大,会导致碳酸氢钠没有完全沉淀出来,所以碳酸钠的产率降低,

练习册系列答案
相关题目