题目内容
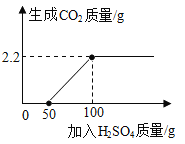
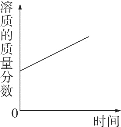
【题目】往 200 克含有稀硝酸和硝酸钙的混合溶液中,加入 21.2%的碳酸钠溶液,所得溶液的 pH变化与加入碳酸钠溶液的质量关系如图(假设生成的气体全部逸出),试分析计算:
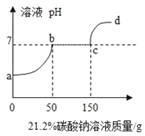
(1)c→d段溶液的 pH大于 7的原因是_____。
(2)反应到 c点时,所得溶液的溶质质量分数是多少_____?(写出计算过程,精确到 0.1%)
【答案】碳酸钠溶液过量,碳酸钠溶液显碱性 16.5%
【解析】
(1) a→b段是碳酸钠与稀硝酸反应,b→c是碳酸钠与硝酸钙反应,c→d是碳酸钠过量,碳酸钠溶液显碱性,PH>7,故c→d段溶液的 pH大于 7的原因是:碳酸钠溶液过量,碳酸钠溶液显碱性;
(2)反应到 c点时,碳酸钠与硝酸钙恰好完全反应,
解:设碳酸钠与稀硝酸反应生成二氧化碳质量为x,生成硝酸钠的质量为m

X=4.4g m=19g
设c点生成硝酸钠的质量为y,生成碳酸钙质量为z
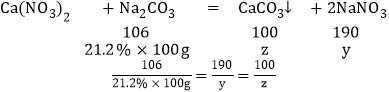
得y=38g z=20g
反应到 c点时,所得溶液的溶质质量分数是:![]()
答:反应到 c点时,所得溶液的溶质质量分数是16.5%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
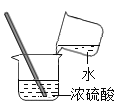
小学生10分钟应用题系列答案【题目】实验室常用过氧化氢溶液和二氧化锰(催化剂)制取氧气。
【提出问题】催化剂二氧化锰的用量对反应速率是否有影响?
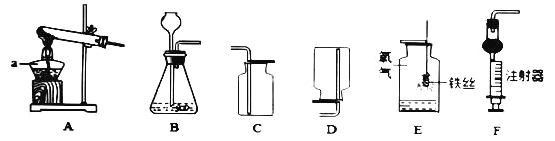
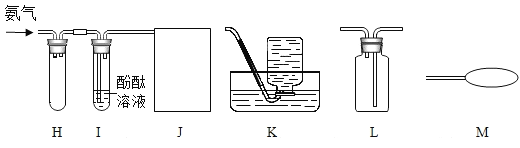
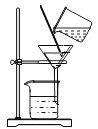
【设计实验】(1)实验装置如图所示:
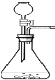

![]() (2)实验记录:实验数据如下表:
(2)实验记录:实验数据如下表:
过氧化氢体积(ml) | 过氧化氢浓度 | 二氧化锰质量(g) | 测量数据(ml) | |
Ⅰ | 30 | 5% | 0.1 | |
Ⅱ | 30 | 5% | 0.2 | |
Ⅲ | 30 | 5% | 0.3 |
【实验分析】(1)过氧化氢分解的文字表达式为____________________;二氧化锰可作为该反应的催化剂的依据是__________________。
(2)表格中的“测量数据”是:相同时间内_______________________
(3)本实验中,测定待测数据的装置(上图中虚线框里)是_______(填编号)。

(4)若第Ⅱ次比第Ⅲ次实验的“测量数据”更______(填“大”或“小”)说明催化剂的用量越多,反应更快。
【实验反思】除了上述因素会影响过氧化氢的反应速率外,_________(写一种)也会影响过氧化氢的分解反应速率,请写出你的实验方案:_______________________