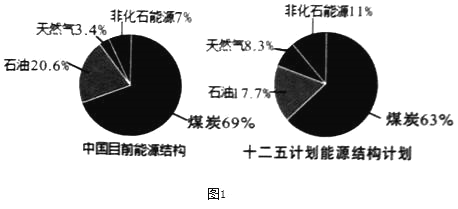
题目内容
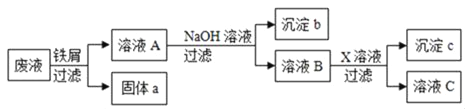
【题目】某废液中只含有Fe(NO3)2、Cu(NO3)2、Ba(NO3)2三种溶质。为了回收金属、保护环境,小科设计了如图方案(所加试剂均过量)。下列判断不正确的是( )
A. 固体a是混合物
B. 溶液B中的含有的盐是Ba(NO3)2和NaNO3
C. X可能是Na2CO3
D. 若回收到6.4g固体a,则加入的铁屑质量为5.6g
【答案】D
【解析】
由于铁的金属活动性大于铜,由题意可知,向废液中加入过量的铁屑,铁能与硝酸铜反应生成了铜和硝酸亚铁,过滤时得到的固体a中应含有铁和铜,向滤液中加入氢氧化钠时,硝酸亚铁能与氢氧化钠反应生成了氢氧化亚铁沉淀和硝酸钠,氢氧化亚铁在空气中已被氧化为氢氧化铁;为了除去钡离子,应加入硫酸钠、碳酸钠等。所以:
A、由上述分析可知,固体a是铜、铁,故A说法正确;
B、由上述分析可知,溶液B中含有的盐有Ba(NO3)2、NaNO3,故B说法正确;
C、由上述分析可知,X可能是Na2SO Na2CO3,故C说法正确;
D、由反应方程式可知铁置换出铜后的固体质量还要增加;则依据D选项可知:两固体的质量差为6.4g﹣5.6g=0.8g
设反应的铁的质量是x
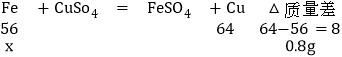
![]()
解得:x=5.6g
由题意知铁是过量的,所以5.6g不可能都反应,与题意矛盾,故D说法错误。
故选:D。

练习册系列答案
相关题目