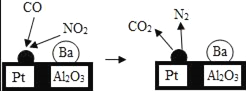
题目内容
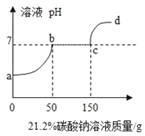
【题目】某兴趣小组在实验室发现一瓶敞口久置的氢氧化钠,为测定氢氧化钠的变质情况,他们取9.3g变质的氢氧化钠样品于锥形瓶中,加入50g水,充分溶解,逐渐加入未知浓度的H2SO4溶液,生成的气体与加入硫酸的质量如图所示:
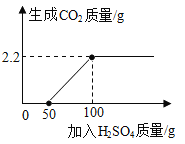
(1)加入稀H2SO4的质量在0~50g时;稀H2SO4与_____发生反应,其反应实质是_____。
(2)所用样品中氢氧化钠的质量分数是多少_____?(精确到0.1%)
【答案】氢氧化钠 氢离子和氢氧根离子反应生成水 43.0%
【解析】
加入稀H2SO4的质量在0~50g时,没有气体生成,是因为稀H2SO4与 氢氧化钠发生反应,其反应实质是 氢离子和氢氧根离子反应生成水。
设稀硫酸的质量分数为x

![]() =
=![]()
x=9.8%
则样品中氢氧化钠的质量分数为y
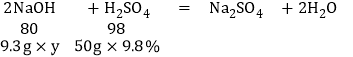
![]() =
=![]()
y=43.0%
答:(1)加入稀H2SO4的质量在0~50g时;稀H2SO4与 氢氧化钠发生反应,其反应实质是 氢离子和氢氧根离子反应生成水。
(2)所用样品中氢氧化钠的质量分数是43.0%。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:

(1)从“海水叶粗盐叶精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是_____(填名称),该仪器在蒸发操作中的作用是_____。
(2)“食盐水”中常含有NaCl,MgCl2,CaCl2等物质,“精制”过程中加入NaOH的目的是_____。
(3)20℃时,“饱和食盐水”的溶质质量分数为26.47%,则该温度下,氯化钠的溶解度为_____(计算结果精确到0.1)。
(4)写出“电解槽”中发生反应的化学方程式:_____。
(5)流程中可以循环使用的物质有_____(填化学式)。
(6)氯碱工业生产的碱样品中常含有Na2CO3和NaCl等杂质,碱样品中含有Na2CO3的原因是_____;检验碱样品中是否含有Na2CO3,下列试剂中可选择使用的是_____(填字母)。
A 酚酞试液 B 石蕊试液 C 硝酸铵溶液 D 澄清石灰水
(7)用“离子交换膜法”生产的碱样品质量主要标准如下表所示:
等级 | 氢氧化钠含量 | 碳酸钠含量 |
优等品 | ≥99.0% | ≤0.5% |
一等品 | ≥98.5% | ≤0.8% |
合格品 | ≥98.0% | ≤1.0% |
化学兴趣B组设计并完成了如下实验来判断碱样品的等级(不考虑其他杂质参加反应)。称取20.3 g碱样品,加入足量的水溶解,再加入足量的氯化钡溶液,充分反应后,过滤得到滤渣和滤液;将滤渣洗涤、干燥,得到碳酸钡固体0.197 g;向滤液中加入2滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5.0%的稀盐酸365 g。
①该碱样品中碳酸钠的含量(质量分数)为_____(计算结果精确到0.01% )。
②列式计算该碱样品中氢氧化钠的含量_____(计算结果精确到0.01% )。
③该碱样品的等级为_____。