题目内容
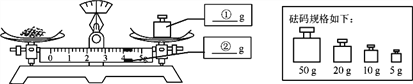
【题目】稀硫酸是一种重要的化学试剂,现用10g 98%的浓硫酸配制10%的稀硫酸,请回答下列问题:
(1)实验的主要步骤有:计算、____________、配制、装瓶并贴标签。
(2)由计算可知,稀释时需加水______________mL(水的密度为:1g/ mL),取水时选用量筒的量程最合适的是_______________(填序号)。
A.25mL B.50mL C.100mL D. 250mL
(3)实验所需要的玻璃仪器有量筒、胶头滴管、烧杯、_______________和试剂瓶。
(4)某课外活动小组为测定某铜锌合金中铜的质量分数,取合金样品10g放入烧杯,向其中逐渐加入10%的稀硫酸,所加稀硫酸与生成氢气质量的关系如图所示。计算:
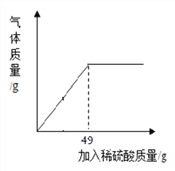
①完全反应后,产生氢气的质量为________g;
②样品中铜的质量分数为___________;(写出计算过程)
【答案】 量取 88 C 玻璃棒 0.1 67.5%
【解析】(1)根据浓硫酸稀释步骤解答;(2)根据计算解答需要水的体积及选择所需量筒;(3)根据浓硫酸稀释需要的仪器解答;(4)根据所加稀硫酸的质量结合反应的化学方程式计算解答。(1)实验的主要步骤有:计算、量取、配制、装瓶并贴标签;(2)设需要加水的质量为x。10g×98%=(10g+x)×10%,x=88g,88g×1g/ mL=88 mL。由计算可知,稀释时需加水88 mL;取水时选用量筒的量程最合适的是100mL,故选C;(3)实验所需要的玻璃仪器有量筒、胶头滴管、烧杯、玻璃棒和试剂瓶;(4)①设完全反应后,产生氢气的质量为x,样品中锌的质量为y。
Zn+H2SO4=ZnSO4+H2↑
65 98 2
y 49×10% x
![]()
x=0.1g
y=3.25g
②样品中铜的质量分数为![]() ×100%=67.5%
×100%=67.5%
答:①完全反应后,产生氢气的质量为0.1g;②样品中铜的质量分数为67.5%。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】铁及其化合物应用广泛。
(一)铁及其化合物的应用
①下图3为某小儿硫酸亚铁糖浆。
(1)适当服用该糖浆可治疗______________(选填序号)。
A.佝偻病 B.侏儒症 C.贫血症
(2)图中不涉及到的材料是_________________(选填序号)。
A.无机材料 B.合成材料 C.复合材料

②食品保鲜“双吸剂”含铁粉、食盐等,上图4为其原理探究实验:
(1)滴入食盐水后,关闭分液漏斗活塞。一段时间后,铁粉上出现红色固体,气球______(选填“变大”、“不变”或“变小”)。
(2)食盐水的作用是______。
(二)铁及其化合物的实验
(1)将废铁屑加入滴有洗涤剂的热水中,充分搅拌以除去油污,这利用了洗涤剂的______作用。
(2)取干燥后的过量铁屑溶于一定量的稀H2SO4(水浴加热控制在50~80℃),搅拌、静置、过滤、洗涤,检验铁粉已洗净的方法是________。
(3)向上述所得滤液中加入饱和(NH4)2SO4溶液,经蒸发浓缩、________、过滤等操作得到浅蓝绿色晶体。
(查阅资料)常见含铁元素的浅蓝绿色晶体有:①硫酸亚铁晶体[FeSO47H2O];
②硫酸亚铁铵晶体[FeSO4(NH4)2SO46H2O]。
(4)取一定量晶体样品,溶于适量水,加入足量的______溶液,微热,并把产生的气体通入酚酞试液,酚酞试液变成______色,说明该晶体是硫酸亚铁铵晶体。
(三)硫酸亚铁铵晶体的热分解实验
兴趣小组称取此晶体样品39.2g,在科研人员的指导下用下图装置进行热分解实验。
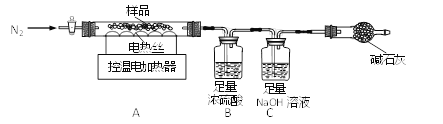
(查阅资料)①硫酸亚铁铵晶体(相对分子质量为392)在100℃完全失去结晶水,剩余物在500℃完全分解为铁的某氧化物、SO2、SO3、NH3和H2O。
②B装置中浓硫酸只能吸收NH3、SO3和H2O。
(1)装配好实验装置后,先要________。
(2)加热前后及过程中均通入N2,停止加热后继续通N2的目的是防止倒吸和________。
(3)控制不同的温度对A中固体加热,测得装置B和C中的质量变化如下表。
温度/℃ | 室温 | 100 | 500 |
B装置/g | 200.00 | x | 228.00 |
C装置/g | 100.00 | 100.00 | 103.20 |
①表格中x =________。
②最终生成SO3的质量为________g,铁的某氧化物的化学式为________。