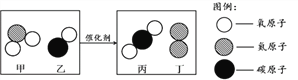
题目内容
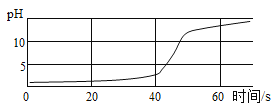
【题目】下列实验方案科学合理的是( )
A. 用降温结晶法使NaC1从海水中析出
B. 用点燃的方法鉴别棉线、毛线和涤纶
C. 用过滤、吸附的方法将硬水软化
D. 用点燃的方法除去CO2中少量的CO
【答案】B
【解析】
A、氯化钠的溶解度受温度影响变化不大,应用蒸发结晶法使![]() 从海水中析出,故A实验方案错误;
从海水中析出,故A实验方案错误;
B、棉线、毛线和涤纶灼烧,分别产生烧纸的气味、烧焦羽毛的气味、特殊气味,可以鉴别三者,故B实验方案正确;
C、用过滤、吸附的方法不能除去水中的可溶性钙镁化合物,不能将硬水软化,故C实验方案错误;
D、除去二氧化碳中的一氧化碳不能够点燃,这是因为会引入新的气体杂质氧气,且当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的,故D实验方案错误。
故选:B。

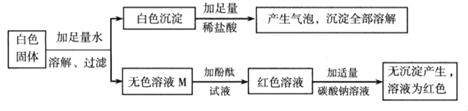
【题目】某白色固体可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种物质组成,同学们为了确定该白色固体的成分,进行了如下实验探究。
(资料卡片)BaCl2溶液显中性
I.初步探究:
同学们设计的实验过程及现象如图所示。
(初步结论)
(1)原白色固体中一定有的物质是_____一定没有的物质是_____。
(2)M溶液中一定有的溶质是_____。
(交流讨论)
同学们认为:无色溶液M变红色,说明溶液M中含有碱性物质,但不能由此推导出原固体物质中是否存在氢氧化钠。若要进一步确定,需对溶液M继续探究。
Ⅱ.继续探究:
(提出问题)无色溶液M中存在氢氧化钠吗?
(猜想与假设)
猜想一:存在氢氧化钠
猜想二:不存在氢氧化钠
(探究与结论)
实验步骤 | 实验现象 | 实验结论 |
A.取无色溶液M于试管,加入过量的氯化钡溶液,振荡,静置 | _____ | 反应的化学方程式为_____;证明溶液M中有碳酸钠并被除尽。 |
B.取实验A所得上层清液于试管中,加入_____。 | _____ | 猜想一正确 |
同学们通过交流、讨论、实验,圆满地完成了实验活动。
【题目】过碳酸钠(化学式为2Na2CO33H2O2)俗名固体双氧水。溶于水可看作是Na2CO3溶液和H2O2溶液混合。为了方便保存,过碳酸钠样品可能添加少量的MgSO4和硅酸镁中的一种或二种作为稳定剂。已知①双氧水可用于供氧、消毒和漂白;②硅酸镁不溶于水。
(1)过碳酸钠的用途不合理的是 。
A.鱼池供氧剂 B.消毒剂 C.干燥剂 D.漂白剂
(2)取少量过碳酸钠样品于烧杯中,加入足量蒸馏水,有不溶于水的固体产生。判断样品中 有硅酸镁。(填写“可能”或“一定”)
(3)利用实验室限选试剂,设计实验确定该样品中是否添加少量的MgSO4。
限选试剂:稀盐酸、稀H2SO4、BaCl2溶液、蒸馏水、AgN03溶液
实验操作 | 预期现象和必要结论 |
步骤:1:取少量样品于烧杯中,缓慢加入足量蒸馏水,充分搅拌,静置,过滤。 |
|
步骤2:取少量步骤1所得的滤液于试管中,加入 ,振荡后静置。 | |
步骤3:取少量步骤2所得的溶液于试管中, 。 | ,说明样品中有MgSO4。 ,说明样品中没有MgSO4。 |