6、化学键:物质中直接相邻的原子或离子之间强烈的相互作用
|
离子化合物:阴、阳离子通过静电作用相成的化合物
离子键:活泼的金属 活泼的非金属
(2) 共价键:原子之间通过共用电子对所形成的强烈的相互作用
共价化合物:通过共用电子对所形成的化合物
非极性键:相同的非金属元素之间 极性键 不同的非金属元素之间
4、硝酸的制备与性质 ★NH4+ 检验:加入NaOH加热产生的气体能使湿润的红色石蕊试纸变蓝
工业制取:(1)氨在催化剂的作用下与氧气发生反应,生成NO
4NH3 + 5O2  4 NO+6 H2O
4 NO+6 H2O
(2)NO与氧气反应生成NO2 2NO+O2=== 2NO2
(3)用水吸收NO2生成硝酸 3NO2 + H2O = 2HNO3+NO
性质:Cu + 4HNO3(浓)=== Cu(NO3)2+2NO2↑+2H2O 3Cu + 8HNO3(稀)==Cu(NO3)2+2NO↑+4H2O
C+ 4HNO3(浓)=== CO2↑+2NO2↑+2H2O

 常温下,浓硫酸使铁铝钝化
常温下,浓硫酸使铁铝钝化
|
|
|
|
|


|



 化学2
化学2
专题五微观结构与物质的多样性
第一单元核外电子排布
 C4H10 CH3CH2CH2CH3 CH3CHCH3 异丁烷
C4H10 CH3CH2CH2CH3 CH3CHCH3 异丁烷
 C5H12 CH3CH2CH2
CH2 CH3 CH3CHCH2
CH2 CH3C CH3
C5H12 CH3CH2CH2
CH2 CH3 CH3CHCH2
CH2 CH3C CH3
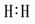 Cl2
Cl2 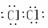 N2
N2  HCl
HCl 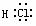 H2O
H2O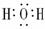 CO2
CO2 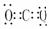 NH3
NH3 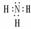 CH4
CH4 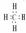 NaCl
NaCl
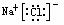 MgCl2
MgCl2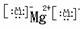 NaOH Na+
NaOH Na+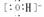
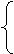 元素周期表 短周期 1、2、3
元素周期表 短周期 1、2、3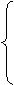 周期 长周期4、5、6
周期 长周期4、5、6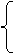 主族 ⅠA-ⅦA
主族 ⅠA-ⅦA 非金属性逐渐增强
非金属性:Cl>S>P>Si,
非金属性逐渐增强
非金属性:Cl>S>P>Si,