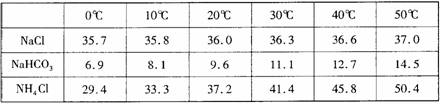
21.(12 分)已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表。
|
元素 |
结构或性质信息 |
|
T |
原子的L层上s电子数等于p电子数。 |
|
X |
元素的原子半径是第三周期主族元素中最大的。 |
|
Y |
空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的。 |
|
Z |
单质常温、常压下是气体。原子的M层上有1个未成对的p电子。 |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式 。
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是 。
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是 。
(4)元素Q的原子序数是X与Z的原子序数之和。
①该元素基态原子的最外层电子排布式为 。
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4] 2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是 。
③元素Q形成的单质的晶体结构如左下图所示,该晶体形成时的原子堆积方式是 (选填“甲”、“乙”、“丙”)。


17.(8分)几种短周期元素的原子半径及其某些化合价见下表:
|
元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
|
常见化合价 |
-1 |
-2 |
+4、-4 |
+6、+4、-2 |
+5、-3 |
+3 |
+2 |
+1 |
|
原子半径/pm |
64 |
66 |
77 |
104 |
110 |
143 |
160 |
186 |
试回答以下问题(涉及上述元素的答案,请用元素符号表示)。
(1)E元素在周期表中位于 。
(2)A、H、J对应离子的半径由大到小的顺序是 。
(3)DB2的结构式 。
(4)过量的D的最高价氧化物,与一定量的J的最高价氧化物对应水化物X的溶液发生反应的离子方程式: 。
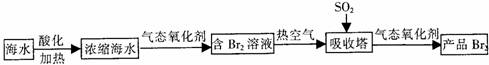
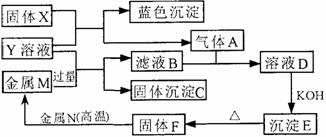 (10分)如下图,已知X为淡黄色固体,Y为中学化学中的一种常见的盐,可用于制农药;M、N均为常见的金属,N的氧化物是冶炼N的原料,也是较好的耐火材料;H为单质气体。下图中部分反应产物已略去。
(10分)如下图,已知X为淡黄色固体,Y为中学化学中的一种常见的盐,可用于制农药;M、N均为常见的金属,N的氧化物是冶炼N的原料,也是较好的耐火材料;H为单质气体。下图中部分反应产物已略去。 (10分)过氧化氢是一种无色透明的无毒液体,常被称为“绿色氧化剂”。
(10分)过氧化氢是一种无色透明的无毒液体,常被称为“绿色氧化剂”。