3. SO2的实验室制法:
|
反应原理 |
Na2SO3+
H2SO4== Na2SO4+ SO2↑+H2O(可加热提高反应速率) Cu+ 2H2SO4 (浓)  CuSO4+ SO2↑+2H2O CuSO4+ SO2↑+2H2O |
|
发生装置 |
固体与液体反应制取气体,发生装置与制Cl2相似 |
|
收集方法 |
向上排空气法 |
|
干燥 |
用浓H2SO4或P2O5酸性干燥剂(不可用碱石灰) |
|
尾气处理 |
用NaOH等碱溶液吸收多余的二氧化硫气体 |
2.SO2的化学性质:(1)具有酸性氧化物的通性:
(2)具有还原性:
(3)具有氧化性 其氧化性比氧气,氯气都弱。
(4)具有漂白性:漂白原理是 和HClO的漂白性的区别 。
★几种物质漂白原理的比较
|
|
SO2 |
氯水、H2O2、Na2O2、O3 |
活性炭 |
|
漂白原理 |
与有色物质结合生成无色物质 |
将有色物质氧化为无色物质 |
吸附有色物质 |
|
变化类型 |
化学变化 |
化学变化 |
物理变化 |
|
是否可逆 |
可逆,加热或日久后恢复原来颜色 |
不可逆,加热或日久后不恢复原来颜色 |
|
 Fe2O3+SO2↑+SO3↑若将生成的气体通入氯化钡溶液中,得到的沉淀是 ( )
Fe2O3+SO2↑+SO3↑若将生成的气体通入氯化钡溶液中,得到的沉淀是 ( ) 解析:3S+6OH‑ △ 2S2-+SO32-+3H2O …………①
解析:3S+6OH‑ △ 2S2-+SO32-+3H2O …………①
 S2-+(x+1)S Sx2- ………………②
S2-+(x+1)S Sx2- ………………②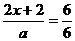 x=
x=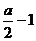
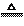 CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑