网址:http://m.1010jiajiao.com/timu_id_4023765[举报]

回答下列问题.
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是
| ||
| △ |
| ||
| △ |
②试管内气体变为红棕色,该反应的化学方程式是
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气,可观察到氨气安静燃烧,此外无其它明显现象.
①两气体通入的先后顺序是
②由实验现象可知,氨气燃烧的化学方程式是
| ||
| ||
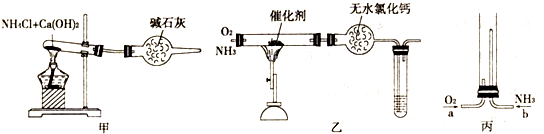
(1)图甲是实验室制取纯净、干燥的氨气的装置图,写出大试管内发生反应的化学方程式:
(2)将产生的氨气与过量的氧气通到装置乙中,用酒精喷灯加热后,试管内气体为
(3)将过量的氧气与甲产生的氨气分别从a、b两管进气口通入到装置丙中,并在b管上端点燃氨气,其氧化产物为空气成分之一.①两气体通入的先后顺序是

(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是__________________;碱石灰的作用是________________________________________________________________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是____________________________________;试管内气体变为红棕色,该反应的化学方程式是______________________________________________。
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中生成了一种二倍于NO2相对分子质量的化合物,试管内气体颜色变浅,请结合化学方程式说明原因__________
_____________________________________________________________________。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,在b管上端点燃氨气未见红棕色气体:
①两气体通入的先后顺序是_______________,其理由是__________________________。
②氨气燃烧的化学方程式是________________________________________________。
查看习题详情和答案>>
图6-14
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是___________;碱石灰的作用____________________。
(2)将产生的氨气与过量的氧气通到装置B (催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是__________试管内气体变为红棕色,该反应的化学方程式是_________________。
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因____________________________________________。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是___________,其理由是______________________________。
②氨气燃烧的化学方程式是_____________________________。
查看习题详情和答案>>
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是______________;碱石灰的作用是_____________________________________________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热;氨催化氧化的化学方程式是_____________________________________________;试管内气体变为红棕色,该反应的化学方程式是____________________________________。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气;
①两气体通入的先后顺序是____________,理由是_________________________________。
②氨气燃烧的化学方程式是_______________________________________________。
查看习题详情和答案>>