网址:http://m.1010jiajiao.com/timu_id_4006988[举报]
生成沉淀的离子反应之所以能够发生,在于生成物的溶解度________AgCl的溶解度仅为1.5×10-4 g。尽管生成物的溶解度________,但并不是绝对________ ,生成的沉淀物会有________。因此生成沉淀后的溶液中有关反应的粒子在反应体系中________。如生成AgCl沉淀后溶液中有关反应的粒子在体系中共存:______________。
从固体溶解平衡的角度可以理解AgCl在溶液中存在下述两个过程:一方面,在水分子作用下,少量________脱离AgCl的表面________水中;另一方面,溶液中的离子受AgCl表面正、负离子的吸引,回到AgCl的表面析出——________。
(1)溶解平衡:在一定温度下,当________和________的速率相等时,即达到溶解平衡状态。如AgCl沉淀体系中的溶解平衡可表示为_____________。由于沉淀、溶解之间的这种动态平衡的存在,决定了Ag+和Cl-的反应________进行到底。
(2)不同电解质在水中的溶解度差别________,但难溶电解质与易溶电解质之间并无严格界限,习惯上将溶解度小于________g的电解质称为难溶电解质。
对于常量的化学反应来说,0.1 g是很小的,因此一般情况下,相当量的离子互相反应生成难溶电解质,可以认为反应完全了。
化学上通常认为残留在溶液中的离子浓度小于________时,沉淀就达完全。
查看习题详情和答案>>科学的发展有一个不断深化的过程。人们对有机化合物的认识同样是这样。
(1)1828年,德国化学家武勒(F?WOhler)冲破了生命力学说的束缚,在实验室里将无机物氰酸铵(NH4CNO)溶液蒸发,得到了有机物尿素[CO(NH2)2]。
|
互为同分异构体的是

|
它不能解释下列 事实
(填入编号)
a.苯不能使溴水褪色
b.苯能与H2 发生加成反应
c.溴苯没有同分异构体
d.邻二溴苯只有一种
将苯与浓硫酸和硝酸混合共热并保存50℃―60℃的温度,可以生成硝基苯。反应后的仪器中有硝基苯、苯和残酸,为得到纯净的硝基苯,要进行中和、水洗,其目的是 ;已知苯的沸点是80℃,硝基苯的沸点是210.9℃,将苯与基苯分离开的实验操作是 。
(3)糖类又称碳水化合物,这是因为过去发现的糖类太多可以用通式Cn(H2O)m来表示。实际上很多符合通式为Cn(H2O)m的化合物并不属于糖类,写出两种符合通式Cn(H2O)m而不属于糖类的有机化合物的结构简式 。
(4)1830年,德国化学家李比希发展了碳、氢分析法,为有机化合物的定量分析打下了基础。某含C、H、O三种元素的未知物,经燃烧实验测定该未知物中碳的质量分数为52.16%,氢的质量分数为13.14%,则A的分子式为 。
A为有关物质存在如下转化关系,B是当今世界产量最大的塑料,广泛用于食品、医药、衣物、化肥等的包装。
![]()
写出下列反应化学方程式
①
。
② 。
查看习题详情和答案>>根据碘与氢气反应的热化学方程式,下列判断正确的是
①I2(g)+H2(g)![]() 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
②I2(s)+H2(g)![]() 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
(1)写出固态碘生成气态碘的热化学方程式:________.
(2)若反应②吸收52.96kJ热量时,转移电子的物质的量是________mol.
(3)对于在恒温、恒容密闭容器中进行的反应①,能说明其达到化学平衡状态的是________.
A.容器中气体压强不变
B.容器中气体密度不变
C.容器中气体颜色的深浅不变
D.有n个H-H键断裂的同时有2n个H-I键断裂
(4)可通过反应2NO+O2=2NO2和NO2+2H++2I-=NO+I2+H2O来制取碘,NO在制碘过程中的作用是________.
(5)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,采用以下方案:如下图所示,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液的蓝色消失时,立即关闭活塞A.
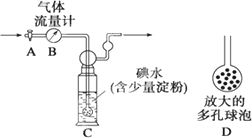
①用碘水测定SO2的含量的化学方程式是________.
②洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是________.
③洗气瓶C中溶液的蓝色消失后,没有及时关闭活塞A,测得的SO2含量________(填“偏高”、“偏低”或“无影响”).
| 时间(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
②计算在80℃时该反应的平衡常数K=
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”)
④要增大该反应的K值,可采取的措施有(填序号)
A.增大N2O4的起始浓度B.向混合气体中通入NO2 C.使用高效催化剂 D.升高温度
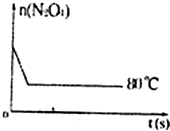
⑤如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线


(2)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp).例如Cu(OH)2(S)?Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)?[c(OH-)]2=2×10-20当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.若某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于
要使0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为
(3)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈

(1)实验室将B、C、E相连后,以
(2)利用实验室常用方法制取氯气,将A、C、E相连,在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验 序号 |
实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气 泡产生 |
氯气与水反应的产物具有酸性 |
实验Ⅱ推出相应的结论是否合理?
(3)A、C、E相连,可设计一个简单的实验,以验证Cl-和Br-的还原性强弱.有关反应的离子方程式为:
| ||
| ||
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验.
①B中发生反应的化学方程式为
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹

