摘要:氧族元素是重要的非金属元素族.而且硫及其化合物硫酸在国民经济建设中有着重要的作用.例如在印染.制药.有机等工业方面是重要的原料.因此本章内容是近几年来高考命题的热点.1.硫及其化合物的性质和相互转化关系 高考在本部分考查的知识点较多.归纳起来主要集中在如下几个方面: ①硫及其化合物的相互转化关系. ②SO2.H2S.SO的还原性. ③浓H2SO4的性质及其应用.硫酸盐的组成. ④以本部分知识为载体的化学计算和化学实验. 以上几个考试热点分散在具体题目中一般具有以下几个命题特点: ①单纯测试元素及化合物的知识.主要以选择题为主.难度不大.目的是起到稳定考生情绪.减少考生焦虑的作用. ②由于硫是一种重要的非金属.硫及其化合物间的转化关系复杂.与其他各族元素以及氧化还原反应等理论知识联系密切.利用这一点编制一些综合性较强的推断题.计算题和实验题.
网址:http://m.1010jiajiao.com/timu_id_3972487[举报]
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)画出元素⑨的原子结构示意图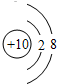
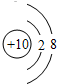 .
.
(2)九种元素中非金属性最强的是
(3)①、②两种元素原子半径比较:①
(4)⑦、⑧两种元素组成的氢化物的热稳定性比较:⑦
(5)元素⑤对应的氢化物的化学式是
(6)①、⑥两元素形成的化合物的电子式为
 ,该化合物是由
,该化合物是由
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑦ | ⑨ | |||
| 3 | ① | ② | ③ | ⑧ |
(1)画出元素⑨的原子结构示意图
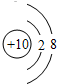
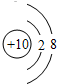
(2)九种元素中非金属性最强的是
F
F
(填元素符号).(3)①、②两种元素原子半径比较:①
>
>
②(填“<”或“>”).在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是NaOH
NaOH
(填化学式).(4)⑦、⑧两种元素组成的氢化物的热稳定性比较:⑦
>
>
⑧(填“<”或“>”).(5)元素⑤对应的氢化物的化学式是
NH3
NH3
,其水溶液的pH>
>
7(填“<”或“>”).④、⑤两种元素对应的最高价含氧酸的酸性强的是HNO3
HNO3
(填化学式).(6)①、⑥两元素形成的化合物的电子式为


离子
离子
(填“共价键”“离子键”)键形成的.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)画出元素⑨的原子结构示意图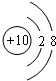
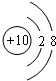 .
.
(2)九种元素中非金属性最强的是
(3)①②两种元素原子半径比较:①
(4)⑦⑧两种元素组成的氢化物的热稳定性比较:⑦
(5)元素⑤对应的氢化物的化学式是
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑦ | ⑨ | |||
| 3 | ① | ② | ③ | ⑧ |
(1)画出元素⑨的原子结构示意图
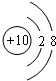
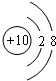
(2)九种元素中非金属性最强的是
F
F
(填元素符号).(3)①②两种元素原子半径比较:①
>
>
②(填“<”或“>”).在①②③三种元素的氧化物对应的水化物中,碱性最强的是NaOH
NaOH
(填化学式).(4)⑦⑧两种元素组成的氢化物的热稳定性比较:⑦
>
>
⑧(填“<”或“>”).(5)元素⑤对应的氢化物的化学式是
NH3
NH3
,其水溶液的pH>
>
7(填“<”或“>”).④⑤两种元素对应的最高价含氧酸的酸性强的是HNO3
HNO3
(填化学式).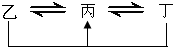 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:(1)写出化合物甲的电子式:


(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式
3NH3?H2O+Al3+=Al(OH)3↓+3NH4+
3NH3?H2O+Al3+=Al(OH)3↓+3NH4+
;写出均含有F元素的乙与丁在溶液中发生反应的离子方程式Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
.(3)由A、C元素组成的化合物戊和A、E元素组成的化合物己,式量均为34.其中戊的熔沸点高于己,其原因是:
H2O2分子间存在氢键
H2O2分子间存在氢键
.(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐.请写出由A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式
NH4)2Fe(SO4)2或(NH4)2Fe(SO4)2?6H2O或(NH4)2SO4?FeSO4?6H2O
NH4)2Fe(SO4)2或(NH4)2Fe(SO4)2?6H2O或(NH4)2SO4?FeSO4?6H2O
.该复盐是一种重要的化学试剂,据中学课本介绍,工业上常用如下方法制取:将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体.写出相关反应的化学方程式(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2?6H2O
(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2?6H2O
,析出该复盐晶体的原理是硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多
硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多
.元素周期表和元素周期律是学习化学的重要工具,可以帮助我们推测元素及其化合物的结构和性质.某元素的原子序数为7,下列有关该元素的推断不正确的是( )
| A、它处于元素周期表中第二周期VA族 | B、它的最高正价为+5,负价为-3 | C、它的最高价氧化物对应水化物是一种强酸 | D、它的非金属性比磷弱比氧强 |