题目内容
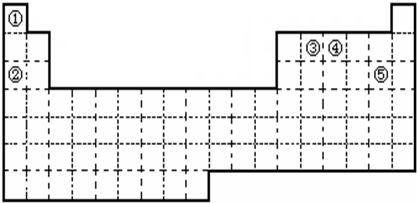
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)画出元素⑨的原子结构示意图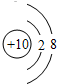
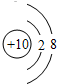 .
.
(2)九种元素中非金属性最强的是
(3)①、②两种元素原子半径比较:①
(4)⑦、⑧两种元素组成的氢化物的热稳定性比较:⑦
(5)元素⑤对应的氢化物的化学式是
(6)①、⑥两元素形成的化合物的电子式为
 ,该化合物是由
,该化合物是由
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑦ | ⑨ | |||
| 3 | ① | ② | ③ | ⑧ |
(1)画出元素⑨的原子结构示意图
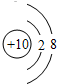
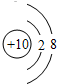
(2)九种元素中非金属性最强的是
F
F
(填元素符号).(3)①、②两种元素原子半径比较:①
>
>
②(填“<”或“>”).在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是NaOH
NaOH
(填化学式).(4)⑦、⑧两种元素组成的氢化物的热稳定性比较:⑦
>
>
⑧(填“<”或“>”).(5)元素⑤对应的氢化物的化学式是
NH3
NH3
,其水溶液的pH>
>
7(填“<”或“>”).④、⑤两种元素对应的最高价含氧酸的酸性强的是HNO3
HNO3
(填化学式).(6)①、⑥两元素形成的化合物的电子式为


离子
离子
(填“共价键”“离子键”)键形成的.分析:(1)根据原子结构示意图的画法来画;
(2)同周期元素的原子从左到右非金属性逐渐增强,同一主族元素的原子从下到上非金属性逐渐增强;
(3)同周期元素原子半径从左到右逐渐减小,最高价氧化物对应水化物的碱性逐渐增强;
(4)同主族元素从上到下氢化物的稳定性逐渐减弱;
(5)氨气水溶液氨水显碱性,硝酸是一种强酸;
(6)氧化钠是氧离子和钠离子间通过离子键形成的离子化合物.
(2)同周期元素的原子从左到右非金属性逐渐增强,同一主族元素的原子从下到上非金属性逐渐增强;
(3)同周期元素原子半径从左到右逐渐减小,最高价氧化物对应水化物的碱性逐渐增强;
(4)同主族元素从上到下氢化物的稳定性逐渐减弱;
(5)氨气水溶液氨水显碱性,硝酸是一种强酸;
(6)氧化钠是氧离子和钠离子间通过离子键形成的离子化合物.
解答:解:根据元素在周期表中的分布情况,可以确定①是Na,②是Mg,③是Al,④是C,⑤是N,⑥是O,⑦是F,⑧是Cl,⑨是Ne.
(1)Ne原子的结构示意图为: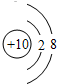 ,故答案为:
,故答案为: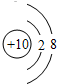 ;
;
(2)同周期元素的原子从左到右非金属性逐渐增强,同一主族元素的原子从下到上非金属性逐渐增强,所以非金属性最强的元素在右上角,即为F,故答案为:F;
(3)根据元素周期律:同周期元素原子半径从左到右逐渐减小,所以原子半径Na>Mg,最高价氧化物对应水化物的碱性逐渐增强,所以碱性:NaOH>Mg(OH)2>Al(OH)3,
故答案为:>; NaOH;
(4)根据元素周期律:同主族元素从上到下氢化物的稳定性逐渐减弱,所以稳定性HF>HCl,故答案为:>;
(5)元素N对应的氢化物的化学式是NH3,其水溶液氨水是弱碱,显碱性,它的pH>7,C、N两种元素对应的最高价含氧酸的酸性:硝酸>碳酸,故答案为:NH3;>;HNO3;
(6)Na、O两元素形成的化合物为氧化钠,氧化钠是氧离子和钠离子间通过离子键形成的离子化合物,它的电子式为 ,
,
故答案为: ;离子.
;离子.
(1)Ne原子的结构示意图为:
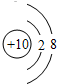 ,故答案为:
,故答案为: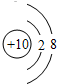 ;
;(2)同周期元素的原子从左到右非金属性逐渐增强,同一主族元素的原子从下到上非金属性逐渐增强,所以非金属性最强的元素在右上角,即为F,故答案为:F;
(3)根据元素周期律:同周期元素原子半径从左到右逐渐减小,所以原子半径Na>Mg,最高价氧化物对应水化物的碱性逐渐增强,所以碱性:NaOH>Mg(OH)2>Al(OH)3,
故答案为:>; NaOH;
(4)根据元素周期律:同主族元素从上到下氢化物的稳定性逐渐减弱,所以稳定性HF>HCl,故答案为:>;
(5)元素N对应的氢化物的化学式是NH3,其水溶液氨水是弱碱,显碱性,它的pH>7,C、N两种元素对应的最高价含氧酸的酸性:硝酸>碳酸,故答案为:NH3;>;HNO3;
(6)Na、O两元素形成的化合物为氧化钠,氧化钠是氧离子和钠离子间通过离子键形成的离子化合物,它的电子式为
 ,
,故答案为:
 ;离子.
;离子.点评:本题是一道关于元素周期表知识的综合题目,学生熟悉元素在周期表中的位置及元素周期律知识即可解答,考查角度广,难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目


 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表是元素周期表的一部分,请依据该表回答问题.
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表是元素周期表的一部分,请依据该表回答问题.

