摘要:硫铁矿高温下空气氧化产物二氧化硫.4FeS2+11O2===8SO2+2Fe2O3设空气中N2.O2的含量分别为0.800和0.200(体积分数.以下气体含量均用体积分数表示).试完成下列各题: (1)1.00 mol FeS2完全氧化.需要空气的体积为 L. (2)55 L空气和足量FeS2完全反应后.气体体积变为 L. (3)用空气氧化FeS2产生的气体混合物中.O2含量为0.0800.计算SO2的含量. (4)设FeS2氧化产物的气体混合物为100 L.其中O2为a L.SO2为b L. ①写出a和b的关系式 ②在图中画出a和b的关系曲线(FeS2氧化时.空气过量20%) 说明:为方便作图.纵坐标用13b表示.
网址:http://m.1010jiajiao.com/timu_id_3972443[举报]
(2002年上海化学卷)化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。
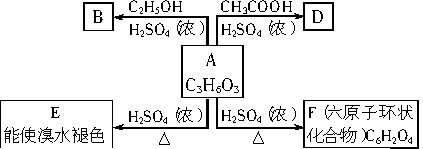
(1)化合物的结构简式:
A__________、 B__________、D_________。
(2)化学方程式:
A→E____________;A→F_____________。
(3)反应类型:
A→E____________;A→F_____________。 查看习题详情和答案>>

(1)化合物的结构简式:
A__________、 B__________、D_________。
(2)化学方程式:
A→E____________;A→F_____________。
(3)反应类型:
A→E____________;A→F_____________。 查看习题详情和答案>>
(2002年上海高考题)制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷目的。人们曾采用过乙醚、NH3、CH3,Cl2等作制冷剂,但它们不是有毒就是易燃,于是科学家根据元素性质的递变规律来开发新的制冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期________>________>H2O、HF。第三周期SiH4>PH3,>H2S>HCI。
(2)化合物的毒性:PH3>NH3;H2S________H2O;CS2________CO2;CCl4>CF4(填>或<、=)。于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76. 8℃,CF4的沸点为一128℃,新的制冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的制冷剂氟利昂CF2Cl2终于诞生了,其他类似的还可以是________。
(4)然而,这种制冷剂造成了当今的某一环境问题是________,但求助于周期表中元素及其化合物的________变化趋势来开发制冷剂的科学思维方法是值得借鉴的(填写字母)。
①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
( )
A. ①②③
B. ②④⑤
C. ②③④
查看习题详情和答案>>
(2002年上海高考题)维通橡胶是一种耐腐蚀、耐油、耐高温、耐寒性能都特别好的氟
橡胶。它的结构简式为合成它的单体为

( )
A. 氟乙烯和全氟异丙烯
B. 1,1—二氟乙烯和全氟丙烯
C. 1—三氟甲基—1,3—丁二烯
D. 全氟异戊二烯
查看习题详情和答案>>