网址:http://m.1010jiajiao.com/timu_id_3966944[举报]
酸、碱、盐都是电解质,在水中都能电离出离子。根据下列化合物:(1)NaOH(2)CH3COOH(3)NH4Cl(4)NH3·H2O(5)CH3COONa请回答下列问题: (1)上述几种电解质中属于弱电解质的是 ,溶液呈酸性的有 (填序号) (2)常温下0.01mol/L NaOH溶液的PH= ;PH=11的CH3COONa溶液中由水电离产生的c(OH-) = (3)用离子方程式表示NH4Cl溶液呈酸性的原因 ,其溶液中离子浓度按由大到小的顺序为 (4)将等PH等体积的NaOH和NH3·H2O分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m n (填“大于、等于、小于”) (5)常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题: 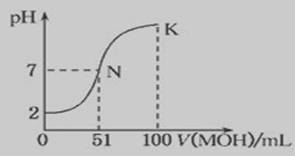
①由图中信息可知HA为________酸(填“强”或“弱”),理由是____________ 。
② K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”、“<”或“=”)。
查看习题详情和答案>>A.含有![]() 、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(
、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.pH=8的氨水与氯化铵的混合溶液中:c(Cl-)>c(![]() )
)
C.0.1 mol·L-1的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
D.pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)=c(H+)
查看习题详情和答案>> 、Cl-、H+、OH-的溶液,其离子浓度一定是:c(Cl-)>c(NH+4)>c(H+)>c(OH-)
、Cl-、H+、OH-的溶液,其离子浓度一定是:c(Cl-)>c(NH+4)>c(H+)>c(OH-)