摘要:少量SO2气体通入NaClO溶液中:2NaClO +2SO2+ 2H2O══Na2 SO4+ 2HCl+H2SO4
网址:http://m.1010jiajiao.com/timu_id_3956832[举报]
(2011?南开区一模)聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理.实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4?7H2O),过程如下:
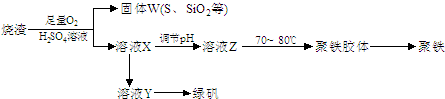
(1)验证固体W焙烧后产生的气体含有SO2的方法是:
(2)实验室制备、收集干燥的SO2,所需仪器如下.装置A产生SO2,按气流方向连接各仪器接口,顺序为a→
装置A中发生反应的化学方程式为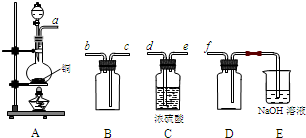
装置D的作用是
(3)制备绿矾时,向溶液X中加入过量
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,定容时视线应
(5)溶液Z的pH影响聚铁中铁的质量分数.若溶液Z的pH偏小,将导致聚铁中铁的质量分数
查看习题详情和答案>>

(1)验证固体W焙烧后产生的气体含有SO2的方法是:
将其气体通入品红试液,溶液褪色,加热恢复红色,证明有二氧化硫
将其气体通入品红试液,溶液褪色,加热恢复红色,证明有二氧化硫
.(2)实验室制备、收集干燥的SO2,所需仪器如下.装置A产生SO2,按气流方向连接各仪器接口,顺序为a→
d
d
→e
e
→c
c
→b
b
→f.装置A中发生反应的化学方程式为
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||

装置D的作用是
安全瓶、防止倒吸
安全瓶、防止倒吸
,装置E中NaOH溶液的作用是吸收多余的二氧化硫
吸收多余的二氧化硫
.(3)制备绿矾时,向溶液X中加入过量
铁屑
铁屑
,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾.过滤所需的玻璃仪器有烧杯、玻璃棒、漏斗
烧杯、玻璃棒、漏斗
.(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,定容时视线应
平视刻度线
平视刻度线
,直到凹液面最低处和刻度相切
凹液面最低处和刻度相切
.用KMnO4标准溶液滴定时应选用酸式
酸式
滴定管(填“酸式”或“碱式”).(5)溶液Z的pH影响聚铁中铁的质量分数.若溶液Z的pH偏小,将导致聚铁中铁的质量分数
偏小
偏小
(填“偏大”、“偏小”或“无影响”).(2010?山东)聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理.实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4?7H2O )过程如下:

(1)验证固体W焙烧后产生的气体含有SO2 的方法是
(2)实验室制备、收集干燥的SO2,所需仪器如下.装置A产生SO2,按气流方向连接各仪器接口,顺序为a→
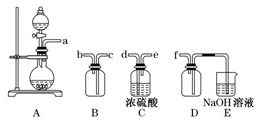
(3)制备绿矾时,向溶液X中加入过量
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为
查看习题详情和答案>>

(1)验证固体W焙烧后产生的气体含有SO2 的方法是
将气体通入品红溶液中,如果品红褪色,加热后又恢复红色.证明有该气体.
将气体通入品红溶液中,如果品红褪色,加热后又恢复红色.证明有该气体.
.(2)实验室制备、收集干燥的SO2,所需仪器如下.装置A产生SO2,按气流方向连接各仪器接口,顺序为a→
d
d
→e
e
→c
c
→b
b
→f装置D的作用是安全瓶,防止倒吸
安全瓶,防止倒吸
,装置E中NaOH溶液的作用是尾气处理,防止污染
尾气处理,防止污染
.
(3)制备绿矾时,向溶液X中加入过量
铁粉
铁粉
,充分反应后,经过滤
过滤
操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾.(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为
将试纸放到表面皿上,用洁净的玻璃棒蘸取少许待测液,滴在试纸的中央.然后与标准比色卡对比.
将试纸放到表面皿上,用洁净的玻璃棒蘸取少许待测液,滴在试纸的中央.然后与标准比色卡对比.
.若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏偏低
偏低
.(2008?平顶山模拟)t℃时,将2mol SO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ/mol.2min时反应达到化学平衡,此时测得反应物O2 还剩余0.8mol.请填写下列空白:
(1)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化2
(2)从反应开始至达到化学平衡,生成SO3平均反应速率为
(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气(已知氦气和SO2、O2、SO3都不发生反应)
(4)上述反应达平衡后,若继续向上述容器中通入1.6mol SO2、0.8mol O2、0.4mol SO3,化学平衡将
(5)t℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到化学平衡时,混合气体体积减少了20%,则SO2的转化率为
查看习题详情和答案>>
(1)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
AB
AB
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化2
(2)从反应开始至达到化学平衡,生成SO3平均反应速率为
0.1mol.L-1.min-1
0.1mol.L-1.min-1
;平衡时混合气体中SO3的物质的量分数为14.3%
14.3%
.(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是
A D
A D
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气(已知氦气和SO2、O2、SO3都不发生反应)
(4)上述反应达平衡后,若继续向上述容器中通入1.6mol SO2、0.8mol O2、0.4mol SO3,化学平衡将
向右
向右
移动(填“向右”、“向左”或“不”),混合气体的平均相对分子质量将增大
增大
(填“增大”、“减小”或“不变”);(5)t℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到化学平衡时,混合气体体积减少了20%,则SO2的转化率为
80%
80%
.(10分)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H=-196.6kJ/mol. 2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
2SO3(g),△H=-196.6kJ/mol. 2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为 ;平衡时SO2转化率为 。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同) 。
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是 。
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为 。