摘要:(二)单质的物理性质 随卤素核电荷数增加.其原子结构的递变而使卤素单质的物理性质呈规律性变化. 归纳:从F2 →I2 1.颜色逐渐 .状态从 → → .密度从 → .熔沸点由 → (原因是 . 2.单质的溶解性--除氟外在水中溶解度都较 .且由 → .都易溶于有机溶剂.下表列出Cl2.Br2.I2在不同溶剂中的颜色. 水 CCl4 Cl2 Br2 I2
网址:http://m.1010jiajiao.com/timu_id_3952344[举报]
(2013?浦东新区二模)化学的魅力之一来自于许许多多的“最”.例如熔点最高的金属是钨,硬度最大的金属是铬,密度最大的金属是锇….根据下面的“最”回答问题:
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式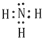
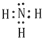 ,该分子属于
,该分子属于
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
(3)就物理性质而言,第二周期原子序数最小的元素的单质是
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等.
查看习题详情和答案>>
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式
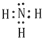
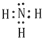
极性
极性
(填“极性”或“非极性”)分子.(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
Na>Cl
Na>Cl
(填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是共价
共价
键.(3)就物理性质而言,第二周期原子序数最小的元素的单质是
密度
密度
最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式:Be(OH)2+2NaOH→Na2BeO2+2H2O
Be(OH)2+2NaOH→Na2BeO2+2H2O
.(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是
a
a
.d
d
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等.
化学的魅力之一来自于许许多多的“最”。例如熔点最高的金属是钨,硬度最大的金属是铬,密度最大的金属是锇……。根据下面的“最”回答问题:
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式 ,该分子属
于 (填“极性”或“非极性”)分子。
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
(填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是 键。
(3)就物理性质而言,第二周期原子序数最小的元素的单质是 最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式: 。
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是 。
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等
查看习题详情和答案>>
(08南昌市二模)下列叙述合理的是( )
A.同一元素的各种同位素的物理性质、化学性质均相同
B.稀有气体元素的原子序数越大,其单质的沸点一定越高
C.所有主族元素原子形成的单核离子的电荷数均与其族序数相等
D.非金属元素的最高正价与最低负价的绝对值之和均为8
查看习题详情和答案>> 价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:
价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:| 等电子体类型 | 代表物质 | 空间构型 |
| 四原子24电子等电子体 | SO3 | 平面三角形 |
| 四原子26电子等电子体 | SO32- | 三角锥形 |
| 五原子32电子等电子体 | CCl4 | 四面体形 |
| 六原子40电子等电子体 | PCl5 | 三角双锥 |
| 七原子48电子等电子体 | SF6 | 八面体形 |
 根据上述信息,回答下列问题:
根据上述信息,回答下列问题:(1)写出分子或离子的空间构型:IO3-
(2)由第一、二周期元素组成,与氧化性最强的单质分子互为等电子体的分子有N2H4
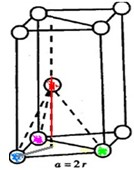
(3)如图是六方最密堆积(Be、Mg、Zn)的晶胞图之一,如果金属镁的密度是ρ g/cm3,且假设镁原子是互相接触的刚性小球,
镁的相对原子质量为M,阿伏加德罗常数为NA,则镁原子的半径为
(1)1811年法国化学家库特瓦用硫酸处理海藻灰时发现了碘.碘单质通常状况下为
(2)1824年法国化学家巴拉尔用氯气处理提取食盐后的盐水母液时发现了溴.溴元素的99%存在于海洋,称作“海洋元素”,其化合物可用作镇静剂.溴的原子序数为35,其原子结构简图为
 ;溴化钠中存在的化学键是
;溴化钠中存在的化学键是
 ,溴化钠的电离方程式为
,溴化钠的电离方程式为
查看习题详情和答案>>
紫黑
紫黑
色固体,其制剂可用来消毒和治疗甲状腺肿.碘缺乏病是目前已知的导致人类智力障碍的主要原因,因此碘元素称作“智慧元素”.碘的单质有两种特性,一是物理特性:易升华
易升华
;二是化学特性:遇淀粉显蓝色
遇淀粉显蓝色
.(2)1824年法国化学家巴拉尔用氯气处理提取食盐后的盐水母液时发现了溴.溴元素的99%存在于海洋,称作“海洋元素”,其化合物可用作镇静剂.溴的原子序数为35,其原子结构简图为


离子键
离子键
,在物理性质上表现出熔沸点较高、硬度较大
熔沸点较高、硬度较大
.氯化钠的电子式为

NaBr=Na++Br-
NaBr=Na++Br-
.检验某固体试样中是否有Br-的方法为取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在
取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在
.