题目内容
 价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:
价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:| 等电子体类型 | 代表物质 | 空间构型 |
| 四原子24电子等电子体 | SO3 | 平面三角形 |
| 四原子26电子等电子体 | SO32- | 三角锥形 |
| 五原子32电子等电子体 | CCl4 | 四面体形 |
| 六原子40电子等电子体 | PCl5 | 三角双锥 |
| 七原子48电子等电子体 | SF6 | 八面体形 |
 根据上述信息,回答下列问题:
根据上述信息,回答下列问题:(1)写出分子或离子的空间构型:IO3-
(2)由第一、二周期元素组成,与氧化性最强的单质分子互为等电子体的分子有N2H4
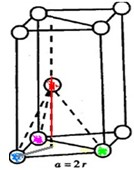
(3)如图是六方最密堆积(Be、Mg、Zn)的晶胞图之一,如果金属镁的密度是ρ g/cm3,且假设镁原子是互相接触的刚性小球,
镁的相对原子质量为M,阿伏加德罗常数为NA,则镁原子的半径为
分析:(1)价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体,等电子体的结构相似,由表格信息分析;
(2)由元素周期表可知氧化性最强的为F2,根据等电子体的概念分析;
(3)镁原子的半径为rcm,晶胞底面为平行四边形,其各边长为a=2r,然后求出其面积,由图可知平行四面体的高度等于两个四面体的高度和,再求出晶胞的体积,根据ρ=
待人已知数据求得r的值.
(2)由元素周期表可知氧化性最强的为F2,根据等电子体的概念分析;
(3)镁原子的半径为rcm,晶胞底面为平行四边形,其各边长为a=2r,然后求出其面积,由图可知平行四面体的高度等于两个四面体的高度和,再求出晶胞的体积,根据ρ=
| m |
| V |
解答:解:(1)已知价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体,等电子体的结构相似,IO3-与SO32-互为等电子体,由表格信息可知二者的空间构型为三角锥形;SO3与SiO32-互为等电子体,由表格信息可知二者的空间构型为平面三角形;
故答案为:三角锥形;平面三角形;
(2)同周期从左到右单质的氧化性增强,同主族从上到下单质的氧化性减弱,所以氧化性最强的为第二周期第VIIA族氟元素的单质F2,由第一、二周期元素组成而且与F2互为等电子体的有N2H4、H2O2、C2H6;
故答案为:H2O2;C2H6;
(3)设镁原子的半径为rcm,晶胞底面为平行四边形,其各边长为a=2r,所以平行四边形的面积为S=a?asin60°=
a2,
晶胞中平行四面体的h=2×边长为a的四面体的高=2×
a=
a,所以V(晶胞)=S×h=
a2×
a=
a3=8
r3,
晶胞中Mg原子个数为1+
×1=2,已知金属镁的密度是ρ g/cm3,镁的相对原子质量为M,阿伏加德罗常数为NA,则ρ=
=
,
即r=
;
故答案为:
.
故答案为:三角锥形;平面三角形;
(2)同周期从左到右单质的氧化性增强,同主族从上到下单质的氧化性减弱,所以氧化性最强的为第二周期第VIIA族氟元素的单质F2,由第一、二周期元素组成而且与F2互为等电子体的有N2H4、H2O2、C2H6;
故答案为:H2O2;C2H6;
(3)设镁原子的半径为rcm,晶胞底面为平行四边形,其各边长为a=2r,所以平行四边形的面积为S=a?asin60°=
| ||
| 2 |
晶胞中平行四面体的h=2×边长为a的四面体的高=2×
| ||
| 3 |
2
| ||
| 3 |
| ||
| 2 |
2
| ||
| 3 |
| 2 |
| 2 |
晶胞中Mg原子个数为1+
| 1 |
| 8 |
| m |
| V |
| ||
8
|
即r=
| 3 |
| ||||
故答案为:
| 3 |
| ||||
点评:本题考查了等电子体以及晶胞的计算,明确等电子体的概念以及晶胞体积与密度、相等原子质量的关系是解本题关键,难度较大,注意晶胞的边长不是金原子直径,题目难度较大.

练习册系列答案
相关题目