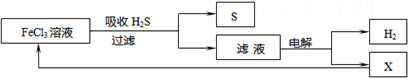
题目内容
(2013?浦东新区二模)化学的魅力之一来自于许许多多的“最”.例如熔点最高的金属是钨,硬度最大的金属是铬,密度最大的金属是锇….根据下面的“最”回答问题:
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式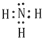
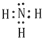 ,该分子属于
,该分子属于
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
(3)就物理性质而言,第二周期原子序数最小的元素的单质是
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等.
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式
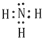
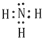
极性
极性
(填“极性”或“非极性”)分子.(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
Na>Cl
Na>Cl
(填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是共价
共价
键.(3)就物理性质而言,第二周期原子序数最小的元素的单质是
密度
密度
最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式:Be(OH)2+2NaOH→Na2BeO2+2H2O
Be(OH)2+2NaOH→Na2BeO2+2H2O
.(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是
a
a
.d
d
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等.
分析:(1)空气中含量最多的元素为N,原子核外电子数最少的元素为H,二者形成的简单物质为NH3;
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素为Na和Cl元素,其中任意三种元素组成的物质有HClO、NaClO、NaOH等;
(3)第二周期原子序数最小的元素的单质是Li,其相邻元素为Be,地壳中含量最多的金属元素为Al;
(4)关于人体内含量最多的元素为O,最硬非金属单质的组成元素C.
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素为Na和Cl元素,其中任意三种元素组成的物质有HClO、NaClO、NaOH等;
(3)第二周期原子序数最小的元素的单质是Li,其相邻元素为Be,地壳中含量最多的金属元素为Al;
(4)关于人体内含量最多的元素为O,最硬非金属单质的组成元素C.
解答:解:(1)空气中含量最多的元素为N,原子核外电子数最少的元素为H,二者形成的简单物质为NH3,为极性分子,电子式为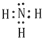 ,故答案为:
,故答案为: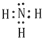 ;极性;
;极性;
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素为Na和Cl元素,同周期元素从左到右原子半径逐渐减小,则原子半径Na>Cl,其中任意三种元素组成的物质有HClO、NaClO、NaOH等,都含有共价键,故答案为:Na>Cl;共价;
(3)二周期原子序数最小的元素的单质是Li,在金属元素中密度最小,其相邻元素为Be,与Al元素的化学性质相似,其氢氧化物具有两性,与碱反应的方程式为Be(OH)2+2NaOH→Na2BeO2+2H2O,故答案为:密度;Be(OH)2+2NaOH→Na2BeO2+2H2O;
(4)关于人体内含量最多的元素为O,最硬非金属单质的组成元素C,
a.O和C组成的物质中,O显负价,说明O得电子能力比C强,则O的非金属性强于C,故a正确;
b.O的氢化物的熔沸点不一定必定比C的氢化物的熔沸点高,一些固态烃的相对分子质量较大,熔沸点较高,故b错误;
c.O和C原子的核外电子云形状都只有球形和纺锤形两种,故c错误;
d.O原子的核外未成对电子数为2,C原子的核外未成对电子数目也为2,二者相等,故d正确.
故答案为:ad.
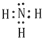 ,故答案为:
,故答案为: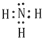 ;极性;
;极性;(2)海水中含量最多的四种元素,除了O、H外,另外二种元素为Na和Cl元素,同周期元素从左到右原子半径逐渐减小,则原子半径Na>Cl,其中任意三种元素组成的物质有HClO、NaClO、NaOH等,都含有共价键,故答案为:Na>Cl;共价;
(3)二周期原子序数最小的元素的单质是Li,在金属元素中密度最小,其相邻元素为Be,与Al元素的化学性质相似,其氢氧化物具有两性,与碱反应的方程式为Be(OH)2+2NaOH→Na2BeO2+2H2O,故答案为:密度;Be(OH)2+2NaOH→Na2BeO2+2H2O;
(4)关于人体内含量最多的元素为O,最硬非金属单质的组成元素C,
a.O和C组成的物质中,O显负价,说明O得电子能力比C强,则O的非金属性强于C,故a正确;
b.O的氢化物的熔沸点不一定必定比C的氢化物的熔沸点高,一些固态烃的相对分子质量较大,熔沸点较高,故b错误;
c.O和C原子的核外电子云形状都只有球形和纺锤形两种,故c错误;
d.O原子的核外未成对电子数为2,C原子的核外未成对电子数目也为2,二者相等,故d正确.
故答案为:ad.
点评:本题综合考查元素之最,涉及元素的含量、用途以及性质,侧重于元素周期表和周期律的考查,题目难度不大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目