摘要:188.配平下列化学方程式 (1)Mn4+H2+H24--Mn4+↓+24+H2 (2)A23+HN3+H2--H3A4+H24+N↑ (3)P4+Hl3+H2--H3P4+Hl (4)(NH4)2Ptl6Pt+NH4l+N2↑+Hl ()r2+I-+H+--r3++I2+H2 (6)N+H3H--N2+2+H2+H-
网址:http://m.1010jiajiao.com/timu3_id_73000[举报]
氟和氟盐均可用作化工原料.由于氟气性质活泼,比较难制取.
(1)不能通过电解纯净的液态HF获得F2,其原因是
放电产生气体的电极反应式:
(2)利用物质间的化学反应也能制取氟气.请配平下列化学方程式:
查看习题详情和答案>>
(1)不能通过电解纯净的液态HF获得F2,其原因是
氟化氢是共价化合物纯液态时不电离
氟化氢是共价化合物纯液态时不电离
;但电解液态KHF2时,两极分别得到F2和H2,写出阳极上H| F | - 2 |
HF2--2e-=F2+H+
HF2--2e-=F2+H+
.(2)利用物质间的化学反应也能制取氟气.请配平下列化学方程式:
2
2
K2MnF6+4
4
SbF6
|
4
4
KSbF6+2
2
MnF3+1
1
F2↑,其中还原产物是MnF3
MnF3
.配平下列化学方程式
 .
.
查看习题详情和答案>>
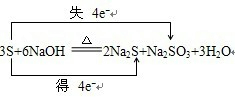
3
3
S+6
6
NaOH
| ||
2
2
Na2S+1
1
Na2SO3+3
3
H2O指出被氧化的元素是S
S
,被还原的元素是S
S
,氧化产物Na2SO3
Na2SO3
,还原产物Na2S
Na2S
,氧化剂与还原剂的质量比是2:1
2:1
并用双线桥表示该反应转移的电子方向和数目

Cu20是不溶于水的碱性物质,能溶于酸发生歧化反应,生成Cu和Cu2+.测Cu20在矿石中含量的方法为:将矿石溶于足量的Fe2(S04)和H2S04的混合溶液中,然后用KMn04测定.
(1)完成并配平下列化学方程式:□Cu2O+□Fe2(SO4)3+□H2SO4--□CuSO4+□FeSO4+□
(2)滴入KMnO4时发生反应的离子方程式为
(3)若每次测定中称取5.00g矿样,滴定时消耗O.10mol/LKMn04溶液100mL.通过计算确定矿样中Cu20的质量分数为
查看习题详情和答案>>
(1)完成并配平下列化学方程式:□Cu2O+□Fe2(SO4)3+□H2SO4--□CuSO4+□FeSO4+□
H2O
H2O
. (2)滴入KMnO4时发生反应的离子方程式为
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O.
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O.
.(3)若每次测定中称取5.00g矿样,滴定时消耗O.10mol/LKMn04溶液100mL.通过计算确定矿样中Cu20的质量分数为
72.0%
72.0%
.
铁及铁的化合物在生产、生活中都有广泛应用.请回答下列问题:
(1)钢铁在空气中容易发生电化学腐蚀而生锈,请写出钢铁在空气中发生吸氧腐蚀时的正极反应方程式 .
(2)黄铁矿(FeS2)是工业生产硫酸的重要原料,其中所发生的一个反应为:3FeS2+8O2
6SO2+Fe3O4,则3molFeS2参加反应转移 mol电子.
(3)FeCl3溶液常用作印刷电路铜板腐蚀剂,该反应的离子方程式为 .
(4)治疗缺铁性贫血可用硫酸亚铁缓释片(Ferrous Sulfate Sustained Release Tablets),其主要成分是FeSO4?7H2O,其说明书上常写有“本品不应与浓茶同服”、“维生素C与本品同服,有利于本品吸收”等.维生素C对硫酸亚铁缓释片的主要作用是 .
某同学为测定某硫酸亚铁缓释片中FeSO4的含量进行了以下实验:
Ⅰ.取10片补血剂,称量,除去糖衣,研细,置于小烧杯中;
Ⅱ.加60mL稀硫酸与新沸过的冷水适量,振摇,使硫酸亚铁缓释片溶解;
Ⅲ.配制成250mL溶液,并从中准确量取20.00mL溶液,用一定物质的量浓度的酸性高锰酸钾溶液滴定.
①步骤Ⅱ中,稀硫酸的作用是 .
②配平下列化学方程式:
KMnO4+ FeSO4+ H2SO4= Fe2(SO4)3+ MnSO4+ K2SO4+ H2O
③该滴定实验中应选择 式滴定管,滴定达到终点时溶液的颜色是 色.
④若每消耗10mL酸性高锰酸钾溶液相当于含0.152g FeSO4,则该高锰酸钾溶液的物质的量浓度是 .
查看习题详情和答案>>
(1)钢铁在空气中容易发生电化学腐蚀而生锈,请写出钢铁在空气中发生吸氧腐蚀时的正极反应方程式
(2)黄铁矿(FeS2)是工业生产硫酸的重要原料,其中所发生的一个反应为:3FeS2+8O2
| ||
(3)FeCl3溶液常用作印刷电路铜板腐蚀剂,该反应的离子方程式为
(4)治疗缺铁性贫血可用硫酸亚铁缓释片(Ferrous Sulfate Sustained Release Tablets),其主要成分是FeSO4?7H2O,其说明书上常写有“本品不应与浓茶同服”、“维生素C与本品同服,有利于本品吸收”等.维生素C对硫酸亚铁缓释片的主要作用是
某同学为测定某硫酸亚铁缓释片中FeSO4的含量进行了以下实验:
Ⅰ.取10片补血剂,称量,除去糖衣,研细,置于小烧杯中;
Ⅱ.加60mL稀硫酸与新沸过的冷水适量,振摇,使硫酸亚铁缓释片溶解;
Ⅲ.配制成250mL溶液,并从中准确量取20.00mL溶液,用一定物质的量浓度的酸性高锰酸钾溶液滴定.
①步骤Ⅱ中,稀硫酸的作用是
②配平下列化学方程式:
③该滴定实验中应选择
④若每消耗10mL酸性高锰酸钾溶液相当于含0.152g FeSO4,则该高锰酸钾溶液的物质的量浓度是
