题目内容
配平下列化学方程式
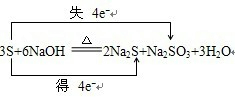
 .
.
3
3
S+6
6
NaOH
| ||
2
2
Na2S+1
1
Na2SO3+3
3
H2O指出被氧化的元素是S
S
,被还原的元素是S
S
,氧化产物Na2SO3
Na2SO3
,还原产物Na2S
Na2S
,氧化剂与还原剂的质量比是2:1
2:1
并用双线桥表示该反应转移的电子方向和数目

分析:氧化还原反应中,化合价升高数=失去电子的数目=化合价降低数=得电子数=转移电子数,根据原子守恒、电子守恒来配平方程式,化合价升高元素被氧化,所在的反应物是还原剂,对应产物是氧化产物,化合价降低元素被还原,所在的反应物是氧化剂,对应产物是还原产物.
解答:解:硫元素化合价既升高又降低,降低2价,升高4价,得失电子应相等,所以转移电子数为4,所以方程式为:3S+6NaOH
2Na2S+Na2SO3+3H2O,化合价升高元素是硫单质中的硫元素被氧化,所在的反应物硫是还原剂,对应产物Na2SO3是氧化产物,化合价降低元素是硫单质中的硫元素被还原,所在的反应物硫单质是氧化剂,对应产物Na2S是还原产物,所以氧化剂与还原剂的质量比是2:1,故答案为:3;6;2;1;3;S;S;Na2SO3;Na2S;2:1; .
.
| ||
 .
.点评:本题考查学生氧化还原反应中的综合知识,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
相关题目

 (2011?深圳一模)氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.
(2011?深圳一模)氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.