摘要:17.工业纯碱中常含有NaCl.Na2SO4等杂质.为了测定工业纯碱中Na2CO3的含量.某同学设计了如下图装置: 试回答下列问题: (1)装置A中发生反应的化学方程式为: . (2)装置D的作用是 . (3)利用上述装置进行实验.即使气密性良好.并缓慢滴加了过量的稀硫酸使反应完全.装置C中装有足量碱石灰.其他操作也正确.测定结果还是偏低.原因可能是: . 你的改进措施是(用文字叙述或在题图中添加所需装置) . (4)实验前所取工业纯碱质量为m g.装置C中碱石灰和U形管的总质量为m1 g.加入足量稀硫酸.反应结束后.装置C中碱石灰和U形管的总质量变为m2 g.则上述实验中测得的工业纯碱中Na2CO3的质量分数为 . (5)利用上图A.B装置(B中仍用浓硫酸做干燥剂).还可以制取哪些气体? . 答案:(1)Na2CO3+H2SO4===Na2SO4+CO2↑+H2O (2)防止空气中的CO2和水蒸气进入C装置 (3)反应生成的部分CO2残留在装置A.B及导管内 向装置内通入除去了CO2的空气或在装置图左边连接下列装置 (4)×100% (5)H2.O2.SO2.NO2.Cl2等
网址:http://m.1010jiajiao.com/timu3_id_72573[举报]
工业纯碱中常含有NaCl、Na2SO4等杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如下图装置:

试回答下列问题:
(1)装置A中发生反应的化学方程式为:________.
(2)装置D的作用是________.
(3)利用上述装置进行实验,即使气密性良好,并缓慢滴加了过量的稀硫酸使反应完全,装置C中装有足量碱石灰,其他操作也正确,测定结果还是偏低,原因可能是:________.
你的改进措施是(用文字叙述或在题图中添加所需装置)________.
(4)实验前所取工业纯碱质量为m g,装置C中碱石灰和U形管的总质量为m1 g,加入足量稀硫酸,反应结束后,装置C中碱石灰和U形管的总质量变为m2 g,则上述实验中测得的工业纯碱中Na2CO3的质量分数为________.
(5)利用上图A、B装置(B中仍用浓硫酸做干燥剂),还可以制取哪些气体?________(填三种气体的化学式).
工业纯碱中常常含有NaCl、Na2SO4等杂质.为粗略测定某工业纯碱的纯度,设计了如图所示的实验装置.依据实验设计,请回答:

(1)装置B中盛装稀硫酸的仪器名称是 ;B中发生反应的离子方程式为 .
(2)为达到实验目的,一次实验中至少应进行称量操作的次数为 .
(3)如果不用装置E,会导致实验结果 (填“偏高”、“偏低”或“无影响”).
(4)最后一次称量前,打开活塞K缓缓通入气体的目的是 .
查看习题详情和答案>>

(1)装置B中盛装稀硫酸的仪器名称是
(2)为达到实验目的,一次实验中至少应进行称量操作的次数为
(3)如果不用装置E,会导致实验结果
(4)最后一次称量前,打开活塞K缓缓通入气体的目的是
工业纯碱中常常含有NaCl、Na2SO4等杂质.为粗略测定某工业纯碱的纯度,设计了如图所示的实验装置.依据实验设计,请回答:
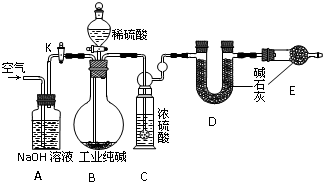
(1)装置B中盛装稀硫酸的仪器名称是______;B中发生反应的离子方程式为______.
(2)为达到实验目的,一次实验中至少应进行称量操作的次数为______.
(3)如果不用装置E,会导致实验结果______(填“偏高”、“偏低”或“无影响”).
(4)最后一次称量前,打开活塞K缓缓通入气体的目的是______.
查看习题详情和答案>>

(1)装置B中盛装稀硫酸的仪器名称是______;B中发生反应的离子方程式为______.
(2)为达到实验目的,一次实验中至少应进行称量操作的次数为______.
(3)如果不用装置E,会导致实验结果______(填“偏高”、“偏低”或“无影响”).
(4)最后一次称量前,打开活塞K缓缓通入气体的目的是______.
