摘要:A.B.C.D.E.F是六种短周期主族元素.它们的原子序数依次增大.其中A.D及C.F分别是同一主族元素.A.F两元素的原子核中质子数之和比C.D两元素原子核中质子数之和少2.F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍.E元素的最外层电子数等于其电子层数.请回答: (1)1mol由E.F二种元素组成的化合物跟由A.C.D三种元素组成的化合物发生反应.完全反应后消耗后者的物质的量为 . (2)A.C.F间可形成甲.乙两种微粒.它们均为负一价双原子阴离子.甲有18个电子.乙有10个电子.则甲与乙反应的离子方程式为 . (3)单质B的燃烧热a kJ/mol.由B.C二种元素组成的化合物BC14g完全燃烧放出b kJ热量.写出单质B和单质C反应生成BC的热化学方程式: . (4)工业上在高温的条件下.可以用A2C和BC反应制取单质A2.在等体积的Ⅰ.Ⅱ两个密闭容器中分别充入1mol A2C和1mol BC.2mol A2C和2mol BC.一定条件下.充分反应后分别达到平衡.下列说法正确的是 A.达到平衡所需要的时间:Ⅰ>Ⅱ B.达到平衡后A2C的转化率:Ⅰ=Ⅱ C.达到平衡后BC的物质的量:Ⅰ>Ⅱ D.达到平衡后A2的体积分数:Ⅰ<Ⅱ E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ (5)用B元素的单质与E元素的单质可以制成电极.浸入由A.C.D三种元素组成的化合物的溶液中构成电池.则电池负极的电极反应式是 [解析]根据题意.F元素的最外层电子数是次外层电子数的0.75倍.即F元素次外层8个电子.最外层6个电子.所以为S元素,根据C和F为同一主族.所以C为O元素.B元素最外层是内层电子数的2倍.即可能为C元素或Si元素.但A.B.C.D.E.F的原子序数依次增大.所以B为C元素,E元素的最外层电子数等于其电子层数.且原子序数大于O元素.所以E为Al元素,根据A.F两元素的原子核中质子数之和比C.D两元素原子核中质子数之和少2.即A+16+2=D+8.所以D-A=10.A.D同主族.所以A为H元素.D为Na元素. (1)Al2S3+8NaOH=2Na[Al(OH)4]+3Na2S,所以消耗NaOH8mol,(2)中两种离子为OH-和HS-离子, +O2(g)=CO2(g), △H=-a KJ/mol,CO(g)+1/2O2(g)=CO2(g), △H=-2bKJ/mol;两式相减可得C(s)+ 1/2O2kJ/mol(4)反应方程式为H2O+CO=CO2+H2.属于恒温恒容且△Vg=0的反应. [答案]HS-+OH-=S2-+H2O +1/2O2kJ/mol (4)AB (5)Al-3e-+4OH-→AlO2-+2H2O
网址:http://m.1010jiajiao.com/timu3_id_71573[举报]
 A、B、C、D、E、F 是第四周期的元素其单质均为固体,其相关的性质如下:
A、B、C、D、E、F 是第四周期的元素其单质均为固体,其相关的性质如下:(1)A、B原子处于基态时,原子核外电子均成对,且核电荷数A>B 写出A的基态外围电子轨道表示式


(2)C与A在周期表同属于一个区的元素,写C2+的核外电子排布式
[Ar]3d9
[Ar]3d9
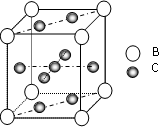
.(3)图是金属B和C所形成的某种合金的晶胞结构示意图,用最简式表示该合金中的组成
CaCu5
CaCu5
.(用B、C元素符号表示)(4)C2+和A2+都能与NH3、H2O、Cl-等形成配位数为4的配合物.[A(NH3)4]2+和[C (NH3)4]2+都具有对称的空间构型,[C(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,而[A(NH3)4]2+中的两个NH3被两个Cl-取代,只能得到一种产物,则[C(NH3)4]2+的空间构型为
平面正方形
平面正方形
.[A(NH3)4]2+A原子轨道的杂化方式为sp3
sp3
.(5)D、E、F均位于P区,电负性D<E<F,第一电离能D<F<E,D只有一个未成对电子.D在元素周期表中有位置是
第四周期第IIIA族
第四周期第IIIA族
,D、E形成化合物的化学式GaAs
GaAs
,该化合物的一种用途是半导体材料
半导体材料
F的最高价氧化物对水化物的分子式为H2SeO4
H2SeO4
.A、B、C、D、E、F 是六种短周期的主族元素,它们的原子序数依次递增;A元素与其它元素均不在同一周期,C元素与B、D元素同周期相邻;C元素的最高价氧化物对应水化物与C元素的气态氢化物X能相互反应生成盐Y;D、F元素同族,E是短周期主族中原子半径最大的元素.请完成下列问题:
(1)D位于元素周期表第 周期 族.
(2)E原子的结构示意图为 .
(3)D和F两元素相比较,非金属性较强的是 (填元素名称),可以验证该结论的事实是
(只写一个即可).
(4)A、D和E三种元素组成的化合物,其所含的化学键类型有 .
(5)检验X的试剂或试纸是 .
(6)由A、C、D三种元素组成的两种强电解质甲和乙,它们的水溶液均呈酸性.若甲抑制水的电离,则甲的化学式为 ;若乙促进水的电离,则乙的水溶液呈酸性的原因是(用离子方程式表示) .
(7)写出D、E两元素形成的原子个数比为1:1的化合物与水反应的化学方程式:
.
(8)A与D间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的离子方程式
.
(9)已知0.4mol 液态C2 A4与液态双氧水反应,生成C2和液态水,放出327.2kJ的热量,该反应的热化学方程式为 .
(10)D、E、F简单离子半径由大到小的顺序为: (用离子符号表示).
(11)写出A、D两种元素形成的化合物的一种用途 .
查看习题详情和答案>>
(1)D位于元素周期表第
(2)E原子的结构示意图为
(3)D和F两元素相比较,非金属性较强的是
(4)A、D和E三种元素组成的化合物,其所含的化学键类型有
(5)检验X的试剂或试纸是
(6)由A、C、D三种元素组成的两种强电解质甲和乙,它们的水溶液均呈酸性.若甲抑制水的电离,则甲的化学式为
(7)写出D、E两元素形成的原子个数比为1:1的化合物与水反应的化学方程式:
(8)A与D间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的离子方程式
(9)已知0.4mol 液态C2 A4与液态双氧水反应,生成C2和液态水,放出327.2kJ的热量,该反应的热化学方程式为
(10)D、E、F简单离子半径由大到小的顺序为:
(11)写出A、D两种元素形成的化合物的一种用途
A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水;D元素原子的次外层电子数比最外层电子数多4,E元素原子的最外层与最内层电子数的差是3.试回答下列问题:
(1)写出下列元素符号:A
(2)用电子式表示B和F形成化合物的过程:
 .
.
(3)写出A、C、F三种元素最高价氧化物对应的水化物相互反应的化学方程式:
查看习题详情和答案>>
(1)写出下列元素符号:A
Na
Na
,CAl
Al
,DSi
Si
,EP
P
.(2)用电子式表示B和F形成化合物的过程:


(3)写出A、C、F三种元素最高价氧化物对应的水化物相互反应的化学方程式:
NaOH+Al(OH)3═NaAlO2+2H2O
NaOH+Al(OH)3═NaAlO2+2H2O
、NaOH+HClO4═NaClO4+H2O
NaOH+HClO4═NaClO4+H2O
、Al(OH)3+3HClO4═Al(ClO4)3+3H2O
Al(OH)3+3HClO4═Al(ClO4)3+3H2O
.(1)有一种叫做钾长石(K2Al2Si6O16),其化学式为写成氧化物的形式为
(2)反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 的离子方程式为:
每生成11.2L标准状况下的气体,被还原的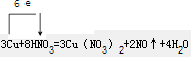
 ;
;
(3)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应①A+H2O→B+C ②C+F→D ③D+NaOH
F+E+H2O写出A、B、C的化学式A
查看习题详情和答案>>
K2O?Al2O3?6SiO2
K2O?Al2O3?6SiO2
;(2)反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 的离子方程式为:
3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O
;每生成11.2L标准状况下的气体,被还原的
硝酸
硝酸
(填名称)的质量为31.5g
31.5g
.得电子与失电子个数比是1:1
1:1
,被氧化与被还原的原子的个数比为3:2
3:2
,试用“单线桥”标出该反应电子转移方向和数目:

(3)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应①A+H2O→B+C ②C+F→D ③D+NaOH
| △ |
NO2
NO2
BNO
NO
CHNO3
HNO3
;写出反应③的离子方程式NH4++OH-
NH3+H2O
| ||
NH4++OH-
NH3+H2O
.
| ||
 (2011?海淀区二模)X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题:
(2011?海淀区二模)X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题:(1)Z元素的原子结构示意图为


(2)A的电子式为


HNO3
HNO3
.(3)写出下列反应的化学方程式:①
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
,③
| ||
| △ |
2NH3+3O2
2HNO2+2H2O
| ||
2NH3+3O2
2HNO2+2H2O
.
| ||
(4)A和E反应生成G,Z2Y是一种麻醉剂,由G在210℃分解生成,该分解反应的化学方程式为
NH4NO3
N2O↑+2H2O
| ||
NH4NO3
N2O↑+2H2O
.
| ||