网址:http://m.1010jiajiao.com/timu3_id_69584[举报]
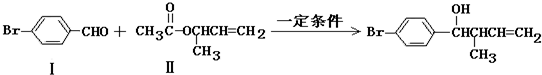
化合物Ⅱ可由化合物Ⅲ合成:
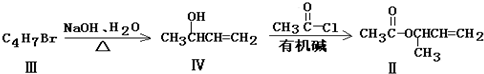
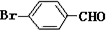
(1)化合物I的分子式为
 +2Ag(NH3)OH
+2Ag(NH3)OH| △ |
 +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O +2Ag(NH3)OH
+2Ag(NH3)OH| △ |
 +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O(2)化合物Ⅱ与Br2加成的产物的结构简式为
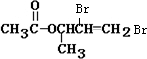
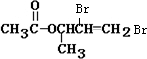
(3)①化合物Ⅲ的结构简式为
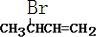
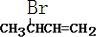
②化合物Ⅲ能在一定条件下发生反应,生成不含甲基的产物,该反应方程式为
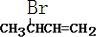 +NaOH
+NaOH| 醇 |
| △ |
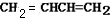 +NaBr
+NaBr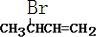 +NaOH
+NaOH| 醇 |
| △ |
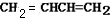 +NaBr
+NaBr(4)①化合物Ⅳ可发生的反应类型是
a.取代反应 b.氧化反应 c.消去反应 d.加成反应
②在碱性条件下,由Ⅳ与
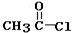 反应合成Ⅱ,该反应方程式为
反应合成Ⅱ,该反应方程式为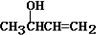 +
+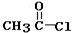
| 碱溶液 |
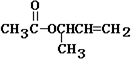 +HCl
+HCl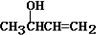 +
+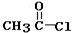
| 碱溶液 |
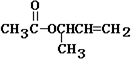 +HCl
+HCl③在一定条件下化合物Ⅳ可以发生加聚反应,其产物结构简式为
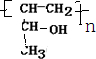
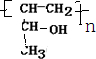
Ⅰ.下列实验操作或对实验事实的叙述正确的是__________(填序号)。
①向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
②一小块金属钠加入水中后迅速熔成小球,不停地在水面游动并发出“嘶嘶”的响声;
③配制100 mL 1.00 mol·L-1 的NaCl溶液时,可用托盘天平称取5.85 g NaCl固体;
④向可能含有![]() ,
,![]() 的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验
的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验![]() 的存在;
的存在;
⑤蒸发NaCl溶液,当得到较多NaCl固体时,就停止加热,利用余热蒸干;
⑥向AlCl3溶液中滴加NaOH溶液和向NaOH溶液中滴加AlCl3溶液的现象相同。
Ⅱ.(1)若实验需用6 mol·L-1 的盐酸250 mL,配制时除需用量筒、烧杯、玻璃棒外,还需用的仪器有:__________、__________。
(2)实验室利用向氨化后的饱和NaCl溶液中通入过量的CO2来制备NaHCO3晶体,为了分离出NaHCO3晶体,必须用到右图中__________(填序号)装置。

(3)写出生成NaHCO3的化学方程式:______________________________。
查看习题详情和答案>>(14分)铁是一种过渡元素,金属铁是最常用的金属。请回答下列各题:
(1)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为 。上述反应生成的磁性固体能溶于过量盐酸,该反应的离子方程式为 。
(2)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(3)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制绿矾。利用烧渣制绿矾的过程如下:
①烧渣溶于稀H2SO4过程中,有单质硫生成,写出该反应的离子方程式(只写生成S的反应式,其他反应无需写出) 。
②向溶液X中加入足量铁屑的目的是 。
③可用硫酸酸化的 KMnO4溶液通过滴定法测定绿矾产品中FeSO4含量,滴定时发生反应的离子方程式为 。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,通过计算说明Fe3+是否沉淀完全 。
(提示:当某离子浓度小于1.0×10-5 mol?L-1时可以认为该离子沉淀完全了)