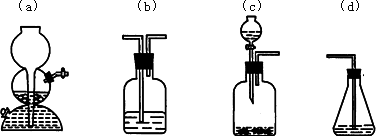
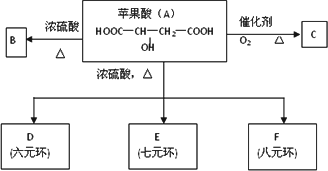
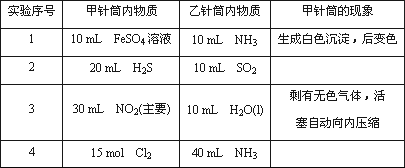
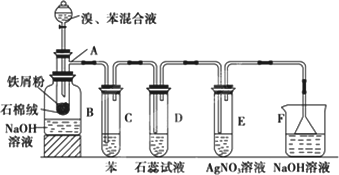
0 88299 88307 88313 88317 88323 88325 88329 88335 88337 88343 88349 88353 88355 88359 88365 88367 88373 88377 88379 88383 88385 88389 88391 88393 88394 88395 88397 88398 88399 88401 88403 88407 88409 88413 88415 88419 88425 88427 88433 88437 88439 88443 88449 88455 88457 88463 88467 88469 88475 88479 88485 88493 203614