【题目】![]() 时,在
时,在![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如下表所示。下列说法不正确的是
的浓度随时间变化如下表所示。下列说法不正确的是
时间 |
|
|
|
| 6 | 0 | ? |
| 3 | 1 |
|
A.![]() 时间内
时间内![]()
B.![]() 时,若升高温度或再充入
时,若升高温度或再充入![]() 气体,都可以提高
气体,都可以提高![]() 的转化率
的转化率
C.![]() 时,
时,![]() 正
正![]() 逆
逆![]()
D.![]() 时,平衡常数
时,平衡常数![]() ,
,![]() 与
与![]() 的转化率相等
的转化率相等
【题目】工业上用粗CuO制备CuCl2晶体的流程如下:
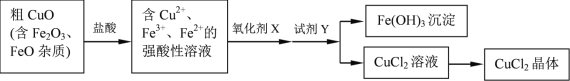
各种离子相关数据如下:
Fe2+ | Cu2+ | Fe3+ | |
开始转化成氢氧化物沉淀时的pH | 7.0 | 4.7 | 1.9 |
完全转化成氢氧化物沉淀时的pH | 9.0 | 6.7 | 3.2 |
请回答:
(1)CuO溶于盐酸的离子方程式是_______________。
(2)已知NaClO为强氧化剂,能将Fe2+氧化为Fe3+。
① NaClO溶液显_______性(填“酸”或“碱”)。你认为用NaClO作氧化剂X是否妥当__________(填“是”或“否”),理由是__________。
②下列另有几种常用的氧化剂,可用作氧化剂X的是__________。
a 浓H2SO4 b C12 c H2O2
(3)试剂Y的作用是调节溶液的pH=3.2,将Fe3+转化为Fe(OH)3沉淀,过滤后得到CuCl2溶液。下列试剂中适宜的是___________。
a NaOH b Na2CO3 c CuCO3 d CuO
(4)为了得到符合质量标准的CuCl2溶液,必须控制溶液的pH____________。
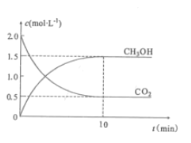
【题目】合成甲醇的反应2H2(g)+CO(g)![]() CH3OH(g) △H= -90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g) △H= -90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度(mol/L) | 0.2 | 0.1 | 0.4 |
(1)写出该反应的平衡常数表达式K=___________________。
(2)该时间段内反应速率v(H2)=______________。
(3)比较此时正、逆反应速率的大小:v正 ___v逆(填“>”、“<”或“=”)
(4)反应达到平衡后,保持其它条件不变,若将容器的体积扩大一倍,v正_____(填“增大”、“减小”或“不变”),v逆______(填“增大”、“减小”或“不变”),平衡向____(填“逆向”、“正向”或“不”)移动,平衡常数K____(填“增大”、“减小”或“不变”)。
【题目】![]() 时,向容积为2L的密闭容器中充入一定量的CH4和H2O,发生反应:
时,向容积为2L的密闭容器中充入一定量的CH4和H2O,发生反应:![]() ,
,![]() 时达到平衡状态,反应过程中测定的部分数据见下表
时达到平衡状态,反应过程中测定的部分数据见下表![]() 表中时间
表中时间![]() :
:
反应时间/min | n(H2O)/mol | n(CO)/mol |
0 | 2.00 | 0.00 |
t1 | 1.60 | |
t2 | 1.40 |
下列说法正确的是 ![]()
![]()
A.反应在![]() 内的平均速率为
内的平均速率为![]()
B.![]() 时,
时,![]()
C.![]() 时,
时,![]() 的转化率为
的转化率为![]()
D.保持其他条件不变,![]() 时
时![]() 向容器中再通入
向容器中再通入![]() ,正反应速率加快,逆反应速率减小
,正反应速率加快,逆反应速率减小
【题目】某温度下, 反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数![]() 。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
起始量 | 甲 | 乙 | 丙 |
H2 (mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C.平衡时,乙中H2的转化率大于60%
D.平衡时,丙中c(H2 ) 是0. 08 mol·L-1