【题目】根据下列操作及现象,所得结论不正确的是![]()
![]()
序号 | 操作及现象 | 结论 |
A | 将 |
|
B | “ |
|
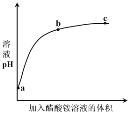
C | 向25mL冷水和沸水中分别滴入5滴 | 温度升高, |
D | 将固体 | 同温下溶解度:
|
A. A B. B C. C D. D
【题目】下列解释实验事实的化学用语不正确的是( )
实验 | 解释 | |
A | 25℃0.1mol/L盐酸溶液pH=1 | H2O=H++OH- |
B | 25℃0.1mol/L的NH3·H2OpH=11 | NH3·H2O |
C | 配制FeCl3溶液时加少量盐酸 | Fe3++3H2O |
D | 向0.1mol/LNa2CO3溶液中滴加酚酞试液后溶液变红 | CO32-+H2O |
A.AB.BC.CD.D
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=______(用K1、K2表示)。
(2)反应③的ΔH____0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度相等,且均为0.1mol·L-1,则此时υ正____υ逆(填“>”、“=”或“<”)
(4)某温度下在2L恒容密闭容器中加入CH3OH发生反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),测得有关数据如下:
CH3OCH3(g)+H2O(g),测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
①反应在2min内以CH3OCH3表示的化学反应速率为____,
②该温度下的反应的平衡常数为____。
【题目】磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)红磷是巨型共价分子,无定型结构,下列方法能证明红磷是非晶体的是_____。
A 质谱法 B 原子发射光谱法 C 核磁共振谱法 D X射线行射法
(2)第一电离能介于Al、P之间的第三周期元素有___种。GaCl3分子中心原子的杂化方式为___。
(3)基态As原子的核外电子排布式为_____,As原子的逐级电离能数据如下:
第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | 第五电离能 | 第六电离能 |
947.0 | 1798 | 2735 | 4837 | 6043 | 12310 |
为什么第五电离能与第六电离能相差较大_____________。
(4)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。

(5)黑磷是新型二维半导体材料,具有片层结构(如下图所示),P原子的杂化形式为_____,层与层之间的相互作用为_____。

(6)GaAs的熔点为1238℃,且熔融状态不导电,其晶胞结构如下图所示,该晶体的类型为_____,每个As原子周围最近的As原子数目为_____,一个GaAs晶胞中配位键的数目为_____。

(7)已知GaAs的密度为dg/cm3,摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,则晶胞中最近的As和Ga原子核间距为_____ nm(列式表示)。