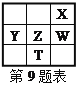
【题目】某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:

请你帮助该同学整理并完成实验报告:
(1)实验目的:_______________。
(2)实验用品:
仪器:________________;药品:__________。
(3)实验内容:(填写题给信息表中的序号)_____
实验方案 | 实验现象 | 有关化学方程式 |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
(4)实验结论:____________。
(5)请用物质结构理论简单说明具有上述结论的原因。__________
(6)请你补充两组简单易行的实验方案,证明此周期中另外两种元素的性质递变规律。_________
【题目】资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为_________;
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
实验序号 | 实验 | 实验现象 | 结论 |
实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为___①______ |
实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量____②_____ | _____③____ | 白色不溶物可能含有猜测2中不溶物 |
实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 _____④____ |
(3)为进一步确定实验1的产物,设计定量实验方案,如图所示:

称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:_________;(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:_________。