【题目】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池和液晶显示器制造中得到广泛应用。![]() 是一种三角锥型分子,键角
是一种三角锥型分子,键角![]() ,沸点
,沸点![]() ;可在铜的催化作用下由
;可在铜的催化作用下由![]() 和过量
和过量![]() 反应得到:
反应得到:
![]() 上述化学方程式中的5种物质所含的化学键类型有 ______
上述化学方程式中的5种物质所含的化学键类型有 ______ ![]() 填序号
填序号![]() 。
。
![]() 离子键
离子键![]() 共价键
共价键![]() 配位键
配位键![]() 金属键
金属键
![]() 与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为 ______ 。
与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为 ______ 。
![]() 的沸点比
的沸点比![]() 的沸点
的沸点![]() 低得多的主要原因是 ______ 。
低得多的主要原因是 ______ 。
![]() 理论上HF、
理论上HF、![]() 和NaCl按6:1:2的物质的量之比恰好反应生成HCl、
和NaCl按6:1:2的物质的量之比恰好反应生成HCl、![]() 和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是 ______ ,配位数为 ______ 。
和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是 ______ ,配位数为 ______ 。
![]() 根据下列五种元素的第一至第四电离能数据
根据下列五种元素的第一至第四电离能数据![]() 单位:
单位:![]()
![]() ,回答下面各题:
,回答下面各题:
元素代号 |
|
|
|
|
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一族的是 ______ 和 ______ 。
②T元素最可能是 ______ (填“s”、“p”、“d”、“ds”等)区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 ______ ,其中心原子的杂化轨道类型为 ______ 。
【题目】A、B、C、D、E是中学化学中常见的四种短周期元素,有关位置及信息如下:
A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F单质是日常生活中用量最大的金属,易被腐蚀或损坏。
| E | A | B | ||
C |
| D |
请回答下列问题:
![]() 元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 ______ 。
元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 ______ 。
![]() 、D的氢化物相互反应,产生白色固体,鉴定该固体需用到的试剂或试纸
、D的氢化物相互反应,产生白色固体,鉴定该固体需用到的试剂或试纸![]() 蒸馏水除外
蒸馏水除外![]() 有 ______ 。
有 ______ 。
![]() 、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为 ______ 。
、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为 ______ 。
![]() 与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: ______ 。
与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: ______ 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
![]() 和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 ______ 。
和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 ______ 。
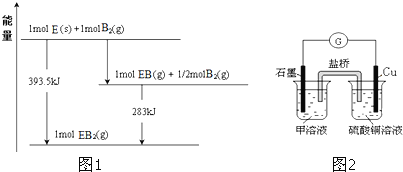
![]() 已知一定量的E单质能在
已知一定量的E单质能在![]()
![]() 中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下
中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下![]() 与
与![]() 反应生成
反应生成![]() 的热化学方程式 ______ 。
的热化学方程式 ______ 。
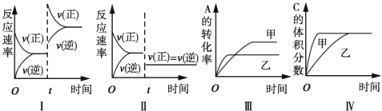
![]() 若在D与F组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极出现的现象是 ______ ,负极的反应式为 ______ 。
若在D与F组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极出现的现象是 ______ ,负极的反应式为 ______ 。