题目内容
【题目】I.下图是X、Y、Z三种固体物质的溶解度曲线。按要求回答下列问题:

(1)若X溶液中混有少量Y,提纯X的操作_______;
(2)若Y溶液中混有少量的X,提纯Y的操作______。
II.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
84消毒液
有效成分 NaClO
规格 1 000 mL
质量分数 25%
密度 1.19 g·cm-3
(1)该“84消毒液”的物质的量浓度约为_______mol·L-1。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=_____mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是__(填字母)。

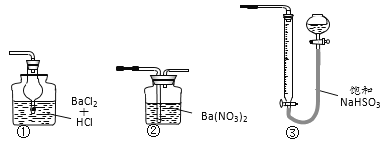
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为______mol·L-1。
②需用浓硫酸的体积为________mL。
【答案】加热浓缩,冷却结晶,过滤 蒸发结晶,趁热过滤 4.0 0.04 C 4.6 250
【解析】
(1)若X溶液中混有少量Y,根据溶解度曲线,X的溶解度受温度的影响较大,Y的溶解度受温度的影响变化不大,应采用加热浓缩,冷却结晶,过滤提纯X,故答案为:加热浓缩,冷却结晶,过滤;
(2)若Y溶液中混有少量的X,根据溶解度曲线,Y的溶解度受温度影响较小,X的溶解度受温度的影响较大,杂质X温度高时溶解度较大,应采用蒸发结晶,趁热过滤提纯Y,故答案为:蒸发结晶,趁热过滤;
II. (1)由标签可知84消毒液的质量分数25%,密度1.19 g·cm-3,该“84消毒液”的物质的量浓度c(NaClO)=![]() ,故答案为:4.0;
,故答案为:4.0;
(2) 该“84消毒液”通常稀释100倍(体积之比)后使用,稀释后的浓度是原浓度的![]() ,即稀释后次氯酸钠的浓度为
,即稀释后次氯酸钠的浓度为![]() ,稀释后的溶液中c(Na+)=c(NaClO)=
,稀释后的溶液中c(Na+)=c(NaClO)= ![]() ,故答案为:0.04;
,故答案为:0.04;
(3) A.配制溶液时需用天平称取溶质质量,在烧杯中溶解,冷却后玻璃棒引流到容量瓶中,加水定容时还要用到胶头滴管,因此如图所示的仪器中,圆底烧瓶和分液漏斗是不需要的,还需要两种玻璃仪器:玻璃棒和胶头滴管,故A错误;
B.容量瓶烘干会对其体积产生影响,故B错误;
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致烧杯玻璃棒上粘有的溶质损失,导致结果偏低,故C正确;
D.欲用NaClO固体配制480 mL溶液,但实验室中没有该规格的容量瓶,根据近且大的选取原则,应选用500mL容量瓶配制,需要称量NaClO固体的质量应按照500mL溶液计算,m(NaClO)=![]() ,故D错误;
,故D错误;
故答案为:C;
(4) ①所配制的稀硫酸为2 L 2.3 mol·L-1,硫酸是强酸完全电离,则H+的物质的量浓度为硫酸浓度的2倍,即4.6 mol·L-1,
故答案为:4.6 mol·L-1;
②98%(密度为1.84 g·cm-3)的浓硫酸的物质的量浓度=![]() ;根据稀释定量
;根据稀释定量![]() ,V(浓)=
,V(浓)=![]() ,故答案为:250;
,故答案为:250;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。反应原CH2=CH2(g)+H2O(g)=CH3CH2OH(g )△H。已知几种共价键的键能如下:
化学键 | C-H | C=C | H-O | C-C | C-O |
键能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是
A. 上述合成乙醇的反应原子利用率为100%
B. 相同时间段内,用该反应中三种物质表示的该反应的化学反应速率相等
C. 碳碳双键的键能大于碳碳单键键能,但碳碳单键更稳定
D. 上述反应式中,△H=+34kJ·mol-1