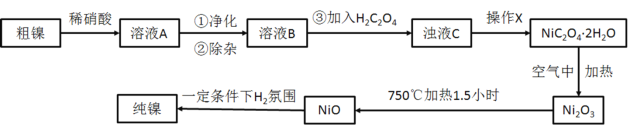
0 201120 201128 201134 201138 201144 201146 201150 201156 201158 201164 201170 201174 201176 201180 201186 201188 201194 201198 201200 201204 201206 201210 201212 201214 201215 201216 201218 201219 201220 201222 201224 201228 201230 201234 201236 201240 201246 201248 201254 201258 201260 201264 201270 201276 201278 201284 201288 201290 201296 201300 201306 201314 203614