【题目】高氯酸铵![]() 为白色晶体,分解时产生大量气体,是复合火箭推进剂的重要成分。
为白色晶体,分解时产生大量气体,是复合火箭推进剂的重要成分。
![]() 高氯酸铵中氯元素的化合价为_____________。
高氯酸铵中氯元素的化合价为_____________。
![]() 高氯酸铵在高温条件下分解会产生H
高氯酸铵在高温条件下分解会产生H![]() 和三种单质气体,请写出该分解反应的化学方程式____________________________。
和三种单质气体,请写出该分解反应的化学方程式____________________________。
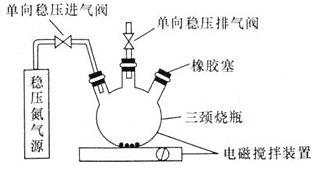
![]() 某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,依次检查装置的气密性、装入试剂、通干燥的惰性气体排尽装置内的空气、将导管末端移入盛满水的试管E、通入气体产物。
某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,依次检查装置的气密性、装入试剂、通干燥的惰性气体排尽装置内的空气、将导管末端移入盛满水的试管E、通入气体产物。![]() 已知:焦性没食子酸溶液用于吸收氧气
已知:焦性没食子酸溶液用于吸收氧气![]()
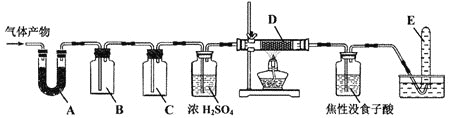
![]() 装置A、B、C、D中盛放的药品可以依次为__________
装置A、B、C、D中盛放的药品可以依次为__________![]() 选填序号:Ⅰ、Ⅱ或Ⅲ
选填序号:Ⅰ、Ⅱ或Ⅲ![]() 。
。
Ⅰ![]() 碱石灰、湿润的淀粉KI试纸、氢氧化钠溶液、Cu
碱石灰、湿润的淀粉KI试纸、氢氧化钠溶液、Cu
Ⅱ![]() 无水硫酸铜、湿润的红色布条、氢氧化钠溶液、Cu
无水硫酸铜、湿润的红色布条、氢氧化钠溶液、Cu
Ⅲ![]() 无水硫酸铜、湿润的淀粉KI试纸、饱和食盐水、Cu
无水硫酸铜、湿润的淀粉KI试纸、饱和食盐水、Cu
![]() 装置E收集到的气体可能是_____________
装置E收集到的气体可能是_____________![]() 填化学式
填化学式![]() 。
。
![]() 经查阅资料,该小组利用反应NaClO4(aq)+NH4Cl(aq)
经查阅资料,该小组利用反应NaClO4(aq)+NH4Cl(aq)![]() NH4ClO4(aq)+NaCl(aq)在实验室制取
NH4ClO4(aq)+NaCl(aq)在实验室制取![]() ,该反应中各物质的溶解度随温度的变化曲线如图。
,该反应中各物质的溶解度随温度的变化曲线如图。
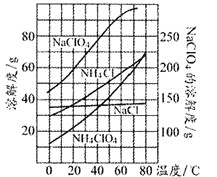
![]() 从混合溶液中获得较多粗NH
从混合溶液中获得较多粗NH![]() ClO
ClO![]() 晶体的实验操作依次为________、_________和过滤、洗涤、干燥。
晶体的实验操作依次为________、_________和过滤、洗涤、干燥。
![]() 研究小组分析认为,若用氨气和浓盐酸代替NH
研究小组分析认为,若用氨气和浓盐酸代替NH![]() Cl,则上述反应不需要外界供热就能进行,其原因是_______________________________。
Cl,则上述反应不需要外界供热就能进行,其原因是_______________________________。
![]() 研究小组通过甲醛法测定所得产品NH
研究小组通过甲醛法测定所得产品NH![]() ClO
ClO![]() 的质量分数。
的质量分数。![]() 已知:NH
已知:NH![]() ClO
ClO![]() 的相对分子质量为
的相对分子质量为![]() ;NH
;NH![]() ClO
ClO![]() 与甲醛反应的离子方程式为
与甲醛反应的离子方程式为![]() ,
,![]() N
N![]() H
H![]()
![]()
![]() N
N![]()
![]()
实验步骤:
步骤Ⅰ![]() 称取
称取![]() 样品。
样品。
步骤Ⅱ![]() 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ![]() 移取
移取![]() 样品溶液于250mL锥形瓶中,加入
样品溶液于250mL锥形瓶中,加入![]() 的中性甲醛溶液
的中性甲醛溶液![]() 过量
过量![]() ,摇匀、静置5min后,加入
,摇匀、静置5min后,加入![]() 滴酚酞试液,用NaOH标准溶液滴定至终点。记录数据。重复
滴酚酞试液,用NaOH标准溶液滴定至终点。记录数据。重复![]() 滴定
滴定![]() 操作2次。
操作2次。
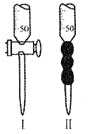
![]() 标准液应盛放在上图装置_________
标准液应盛放在上图装置_________![]() 填“Ⅰ”或“Ⅱ”
填“Ⅰ”或“Ⅱ”![]() 中,判断达到滴定终点的现象是__________。
中,判断达到滴定终点的现象是__________。
![]() 滴定结果如下表所示:
滴定结果如下表所示:
滴定次数 | 标准溶液的体积 | |
滴定前刻度 | 滴定后刻度 | |
1 |
|
|
2 |
|
|
3 |
|
|
则所用标准溶液的体积为___________mL,若NaOH标准溶液的浓度为![]() ,则该产品中
,则该产品中![]() 的质量分数为_____________。
的质量分数为_____________。
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低负化合价 | -2 | -3 | -1 | -3 |
(1)⑧号元素在周期表中的位置是____;上述元素处于同一主族的有____。(用元素符号表示)
(2span>)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式:____。
(3)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
①![]() Li和
Li和![]() Li作核反应堆最佳热载体,
Li作核反应堆最佳热载体,![]() LiH和
LiH和![]() LiD用作高温堆减速剂。下列说法正确的是____。
LiD用作高温堆减速剂。下列说法正确的是____。
A.![]() Li和
Li和![]() Li互为同位素 B.
Li互为同位素 B.![]() Li和
Li和![]() Li属于同种核素
Li属于同种核素
C.![]() LiH和
LiH和![]() LiD的化学性质不同 D.
LiD的化学性质不同 D.![]() LiH和
LiH和![]() LiD是同种物质
LiD是同种物质
②下列说法不正确的是____。
A.碱性:Be(OH)2<LiOH<NaOH<KOH
B.半径:K>Na>Li>Li+
C.氧化性:Li+<Na+<K+<Rb+<Cs+
D.金属性:Cs>Rb>K>Na>Li>Be